Vous ne trouvez pas le bon médicament ? Nous pouvons vous aider
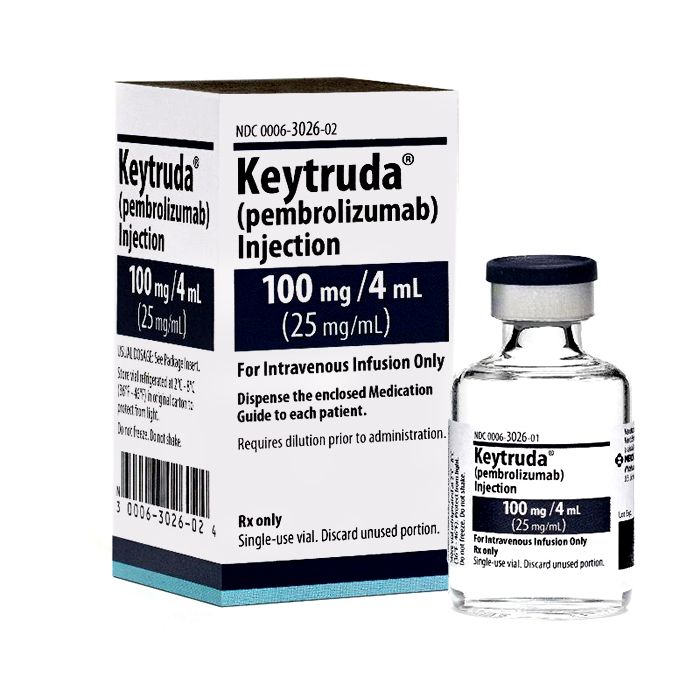
Keytruda pembrolizumab
Nous pouvons vous aider à établir votre ordonnance. Lisez le "Guide de prescription".
Vous pouvez accéder à ce médicament même s'il n'est pas autorisé dans votre pays. Apprenez comment.
Keytruda pembrolizumab) est un médicament utilisé pour le traitement du mélanome avancé, du CBNPC non squameux métastatique, du carcinome épidermoïde de la tête et du cou (HNSCC) récurrent ou métastatique, du lymphome de Hodgkin classique (cHL) récurrent, carcinome urothélial localement avancé ou métastatique, tumeurs solides présentant les biomarqueurs MSI-H ou dMMR, adénocarcinome gastrique ou gastro-œsophagien récurrent localement avancé ou métastatique, carcinome à cellules rénales, cancer du sein triple négatif.
Remarque : Keytruda pembrolizumab) n'est actuellement disponible que sous la forme de 100mg (100mg/4ml). Il existait auparavant une présentation à 50mg mais celle-ci a été supprimée depuis le 15 mars 2019.
Indications de la maladie
Carcinome urothélial, cancer du sein, cancer colorectal, cancer gastrique, cancer de la tête et du cou, cancer du rein, cancer du poumon, lymphome, cancer de la peau
Fabricant
Merck Sharp
Utilisation
Intraveineuse
Médicament approuvé par
-
Agence médicale européenne (EMA)

-
Administration des aliments et des médicaments (FDA)

-
Santé Canada

-
Administration des produits thérapeutiques (TGA)

-
Medsafe (NZ)

Patients aidés
- Plus de 1,2 million de patients touchés

- Plus de 11 000 patients aidés

- 100% de livraisons réussies dans 88 pays

Nous pouvons vous aider avec vos documents d'importation
Nous sommes des experts en matière de réglementation des importations. Faites défiler la page ci-dessous pour télécharger le guide d'importation de votre pays.
QUESTIONS FRÉQUEMMENT POSÉES
Nous vous aidons à accéder à des médicaments approuvés qui ne sont pas approuvés ou disponibles dans votre pays de résidence. pays de résidence.
Juridique
Nous vous aidons à accéder à des médicaments approuvés qui ne sont pas approuvés ou disponibles dans votre pays de résidence. pays de résidence.
Juridique
Finances
Paiement
- Votre résidence permanente se trouve en dehors de l'Union européenne
- Vous emportez les médicaments non utilisés dans les 90 jours suivant l'achat.
- Vous disposez d'un reçu original complet (que nous vous fournissons)
Malheureusement, nous ne sommes pas en mesure de vous aider à rembourser la TVA à la suite d'une livraison ou d'une collecte auprès de nos pharmacies partenaires en dehors des Pays-Bas.
- Si vous résidez dans l'Union européenne et que vous n'êtes pas une entreprise
- Si vous venez chercher votre commande à Amsterdam, Luxembourg ou Düsseldorf
En cas d'enlèvement, vous pouvez bénéficier d'un remboursement de la TVA si vous résidez en dehors de l'Union européenne.
Prix
Remboursement
- Vous souhaitez importer un médicament autorisé de l'étranger.
- l'absence d'options thérapeutiques raisonnables dans votre pays (si vous le pouvez, joignez une lettre d'un médecin le confirmant) - l'absence d'alternative au traitement.
- Le médicament a déjà été approuvé dans un autre pays (indiquer le nom du pays).
- que votre médecin traitant déclare que ce médicament est la meilleure option pour vous (joindre une copie de l'ordonnance à la lettre adressée à la caisse d'assurance maladie).
Commande et expédition
Commande
- Nom du patient
- Coordonnées du patient (courriel et numéro de téléphone)
- Copie de la carte d'identité du patient
- Coordonnées du médecin (nom, adresse, courriel et numéro de téléphone)
- Adresse de livraison
- Copie de l'ordonnance du médecin
Expédition : Nous pouvons livrer au domicile du patient, dans une pharmacie, au cabinet du médecin ou à l'hôpital, mais cela dépend du pays. Si vous n'êtes pas sûr du choix qui s'offre à vous, veuillez contacter notre équipe d'assistance aux patients et nous vous aiderons à définir vos besoins exacts.
Une fois ces informations reçues, l'un des membres de notre équipe d'assistance aux patients vérifiera votre ordonnance et vous contactera pour assurer le suivi de votre commande. Veuillez noter que d'autres documents peuvent être nécessaires pour l'importation. Nous vous guiderons tout au long du processus de commande.
Généralement non, mais nous vous fournissons une facture après le paiement que vous pouvez envoyer à votre compagnie d'assurance médicale pour qu'elle vous rembourse. Dans certaines circonstances limitées, nous acceptons les assurances. Contactez-nous pour plus de détails.
Dans le cadre de nos protocoles, nous pouvons être amenés à contacter votre médecin traitant pour vérification ou mise à jour des informations. En nous envoyant votre ordonnance, vous nous autorisez à le faire.
- Nom et date de naissance du patient
- Nom du médicament et dosage
- Quantité requise
- Nom et signature du médecin
- Numéro d'enregistrement du médecin et/ou cachet
Idéalement, l'ordonnance doit être rédigée en anglais. Sinon, une traduction (non officielle) doit être fournie.
Sachez que votre médecin peut être contacté par l'un des membres de notre équipe ou par la pharmacie chargée du traitement afin de vérifier l'ordonnance.
Expédition
Veuillez noter qu'en raison de la situation du COVID-19 dans le monde et des fermetures de pays, nous subirons parfois des retards dans les expéditions.
Pour les médicaments approuvés par l'EMA et prescrits dans l'espace Schengen, vous pouvez retirer les médicaments dans notre pharmacie partenaire à Amsterdam, Luxembourg ou Düsseldorf. Pour les médicaments non approuvés par l'EMA et prescrits dans l'espace Schengen, vous pouvez retirer les médicaments dans notre pharmacie partenaire de Düsseldorf. Si vous avez demandé à récupérer vos médicaments, vous recevrez une notification lorsque les médicaments seront dans la pharmacie et prêts pour vous.
Il existe également des options de livraison des médicaments dans d'autres pays. Veuillez contacter notre équipe d'assistance aux patients pour discuter des autres options d'enlèvement et de livraison qui pourraient vous convenir.
- Copie de la carte d'identité/du passeport du patient
- Copie de la carte d'identité/du passeport de la personne qui vient chercher les médicaments
- Lettre signée par le patient indiquant qu'il autorise cette personne à venir chercher les médicaments en son nom.
- Étape 1 - Les douanes peuvent avoir besoin de vérifier le contenu du colis. Afin de simplifier cette étape, nous incluons une lettre pour les douanes avec des informations sur le contenu. Toute question supplémentaire sera traitée par everyone.org au fur et à mesure que les douanes nous contacteront.
- Étape 2 - Dans certains pays, les agences de réglementation médicale (c'est-à-dire la FDA, l'EMA, etc.) posent des questions supplémentaires. Nous leur fournissons toutes les informations nécessaires sur la base des informations fournies par le patient, telles que l'ordonnance, une copie de la pièce d'identité et une lettre du médecin traitant attestant que les médicaments sont destinés à un usage personnel.
- Étape 3 - Frais de douane. Dans certains cas, le destinataire devra payer des taxes et des droits de douane. Ceux-ci doivent être réglés par le patient ou le destinataire et ne sont pas couverts par everyone.org , sauf indication contraire.
Veuillez noter que l'importation de médicaments nécessite toujours un dédouanement et une coopération active de la part de la partie importatrice. Nous vous aiderons et vous guiderons, mais nous dépendons de votre coopération et de votre réactivité.
A propos de nous
- Remplir le formulaire de demande de renseignements sur notre page Contactez-nous
- Envoyer un courriel : [email protected]
- Appelez-nous au :
- +31 20 808 4414 (EU)
- +1 646 381 0675 (US)
- +61 28 417 2910 (AUS)
Autres
Médicaments disponibles
Approbation des médicaments
Les agences nationales et régionales respectives, telles que la Food and Drugs Administration (FDA) aux États-Unis ou l'Autorité médicale européenne (EMA) pour l'Union européenne, évaluent ces demandes et décident d'approuver ou non les nouveaux médicaments. Le processus d'examen est basé sur l'évaluation des preuves fournies par l'entreprise. Chaque agence utilise un processus légèrement différent.
- Phase I - réalisée sur un petit nombre de volontaires en bonne santé ou de patients très malades ne disposant pas d'options thérapeutiques, destinée à étudier les effets du médicament sur le corps humain.
- Phase II - un plus grand nombre de patients, conçu pour évaluer la sécurité et l'efficacité du médicament et pour déterminer si des dosages différents du traitement ont des effets différents.
- Phase III - grand nombre de groupes de patients, destinés à confirmer la sécurité et l'efficacité du médicament.
- Phase IV - après que le médicament a reçu l'approbation réglementaire, destinée à évaluer les effets à long terme.
Mises à jour
Finances
Paiement
- Votre résidence permanente se trouve en dehors de l'Union européenne
- Vous emportez les médicaments non utilisés dans les 90 jours suivant l'achat.
- Vous disposez d'un reçu original complet (que nous vous fournissons)
Malheureusement, nous ne sommes pas en mesure de vous aider à rembourser la TVA à la suite d'une livraison ou d'une collecte auprès de nos pharmacies partenaires en dehors des Pays-Bas.
- Si vous résidez dans l'Union européenne et que vous n'êtes pas une entreprise
- Si vous venez chercher votre commande à Amsterdam, Luxembourg ou Düsseldorf
En cas d'enlèvement, vous pouvez bénéficier d'un remboursement de la TVA si vous résidez en dehors de l'Union européenne.
Prix
Remboursement
- Vous souhaitez importer un médicament autorisé de l'étranger.
- l'absence d'options thérapeutiques raisonnables dans votre pays (si vous le pouvez, joignez une lettre d'un médecin le confirmant) - l'absence d'alternative au traitement.
- Le médicament a déjà été approuvé dans un autre pays (indiquer le nom du pays).
- que votre médecin traitant déclare que ce médicament est la meilleure option pour vous (joindre une copie de l'ordonnance à la lettre adressée à la caisse d'assurance maladie).
Commande et expédition
Commande
- Nom du patient
- Coordonnées du patient (courriel et numéro de téléphone)
- Copie de la carte d'identité du patient
- Coordonnées du médecin (nom, adresse, courriel et numéro de téléphone)
- Adresse de livraison
- Copie de l'ordonnance du médecin
Expédition : Nous pouvons livrer au domicile du patient, dans une pharmacie, au cabinet du médecin ou à l'hôpital, mais cela dépend du pays. Si vous n'êtes pas sûr du choix qui s'offre à vous, veuillez contacter notre équipe d'assistance aux patients et nous vous aiderons à définir vos besoins exacts.
Une fois ces informations reçues, l'un des membres de notre équipe d'assistance aux patients vérifiera votre ordonnance et vous contactera pour assurer le suivi de votre commande. Veuillez noter que d'autres documents peuvent être nécessaires pour l'importation. Nous vous guiderons tout au long du processus de commande.
Généralement non, mais nous vous fournissons une facture après le paiement que vous pouvez envoyer à votre compagnie d'assurance médicale pour qu'elle vous rembourse. Dans certaines circonstances limitées, nous acceptons les assurances. Contactez-nous pour plus de détails.
Dans le cadre de nos protocoles, nous pouvons être amenés à contacter votre médecin traitant pour vérification ou mise à jour des informations. En nous envoyant votre ordonnance, vous nous autorisez à le faire.
- Nom et date de naissance du patient
- Nom du médicament et dosage
- Quantité requise
- Nom et signature du médecin
- Numéro d'enregistrement du médecin et/ou cachet
Idéalement, l'ordonnance doit être rédigée en anglais. Sinon, une traduction (non officielle) doit être fournie.
Sachez que votre médecin peut être contacté par l'un des membres de notre équipe ou par la pharmacie chargée du traitement afin de vérifier l'ordonnance.
Expédition
Veuillez noter qu'en raison de la situation du COVID-19 dans le monde et des fermetures de pays, nous subirons parfois des retards dans les expéditions.
Pour les médicaments approuvés par l'EMA et prescrits dans l'espace Schengen, vous pouvez retirer les médicaments dans notre pharmacie partenaire à Amsterdam, Luxembourg ou Düsseldorf. Pour les médicaments non approuvés par l'EMA et prescrits dans l'espace Schengen, vous pouvez retirer les médicaments dans notre pharmacie partenaire de Düsseldorf. Si vous avez demandé à récupérer vos médicaments, vous recevrez une notification lorsque les médicaments seront dans la pharmacie et prêts pour vous.
Il existe également des options de livraison des médicaments dans d'autres pays. Veuillez contacter notre équipe d'assistance aux patients pour discuter des autres options d'enlèvement et de livraison qui pourraient vous convenir.
- Copie de la carte d'identité/du passeport du patient
- Copie de la carte d'identité/du passeport de la personne qui vient chercher les médicaments
- Lettre signée par le patient indiquant qu'il autorise cette personne à venir chercher les médicaments en son nom.
- Étape 1 - Les douanes peuvent avoir besoin de vérifier le contenu du colis. Afin de simplifier cette étape, nous incluons une lettre pour les douanes avec des informations sur le contenu. Toute question supplémentaire sera traitée par everyone.org au fur et à mesure que les douanes nous contacteront.
- Étape 2 - Dans certains pays, les agences de réglementation médicale (c'est-à-dire la FDA, l'EMA, etc.) posent des questions supplémentaires. Nous leur fournissons toutes les informations nécessaires sur la base des informations fournies par le patient, telles que l'ordonnance, une copie de la pièce d'identité et une lettre du médecin traitant attestant que les médicaments sont destinés à un usage personnel.
- Étape 3 - Frais de douane. Dans certains cas, le destinataire devra payer des taxes et des droits de douane. Ceux-ci doivent être réglés par le patient ou le destinataire et ne sont pas couverts par everyone.org , sauf indication contraire.
Veuillez noter que l'importation de médicaments nécessite toujours un dédouanement et une coopération active de la part de la partie importatrice. Nous vous aiderons et vous guiderons, mais nous dépendons de votre coopération et de votre réactivité.
A propos de nous
- Remplir le formulaire de demande de renseignements sur notre page Contactez-nous
- Envoyer un courriel : [email protected]
- Appelez-nous au :
- +31 20 808 4414 (EU)
- +1 646 381 0675 (US)
- +61 28 417 2910 (AUS)
Autres
Médicaments disponibles
Approbation des médicaments
Les agences nationales et régionales respectives, telles que la Food and Drugs Administration (FDA) aux États-Unis ou l'Autorité médicale européenne (EMA) pour l'Union européenne, évaluent ces demandes et décident d'approuver ou non les nouveaux médicaments. Le processus d'examen est basé sur l'évaluation des preuves fournies par l'entreprise. Chaque agence utilise un processus légèrement différent.
- Phase I - réalisée sur un petit nombre de volontaires en bonne santé ou de patients très malades ne disposant pas d'options thérapeutiques, destinée à étudier les effets du médicament sur le corps humain.
- Phase II - un plus grand nombre de patients, conçu pour évaluer la sécurité et l'efficacité du médicament et pour déterminer si des dosages différents du traitement ont des effets différents.
- Phase III - grand nombre de groupes de patients, destinés à confirmer la sécurité et l'efficacité du médicament.
- Phase IV - après que le médicament a reçu l'approbation réglementaire, destinée à évaluer les effets à long terme.
Mises à jour
Conforme au PIB. Voir le certificat.
Distributeur en gros sous licence. Voir le certificat.
Téléchargez votre guide gratuit sur l'importation de médicaments dans votre pays.
Indiquez votre adresse électronique ci-dessous pour recevoir un guide étape par étape pour importer légalement et en toute sécurité des médicaments non disponibles dans votre pays.


Merci de votre attention !
Vous recevrez un courriel contenant un lien de téléchargement vers votre guide (ou une confirmation si vous avez choisi Autre) à l'adresse suivante [email protected]. Veuillez vérifier votre dossier de spam ou de courrier indésirable.
Retour à la pageLaissez-nous vous aider
Si vous avez des questions ou si vous avez besoin d'aide, nous sommes à votre disposition par téléphone. Notre équipe est disponible du lundi au vendredi entre 9 heures et 18 heures CET.
Nous répondons généralement aux courriels dans les 24 heures ouvrables
A propos de nous
Nous sommes une équipe dévouée d'experts en accès aux médicaments, de médecins et de pharmaciens. Nous venons du monde entier. Nous avons perdu des parents et des amis qui ne pouvaient pas obtenir les médicaments dont ils avaient besoin parce qu'ils vivaient dans le mauvais pays.
Notre mission est de fournir à chacun le bon traitement au bon moment. Où que vous viviez. Parce que vous ne devriez pas souffrir ou mourir si un traitement qui pourrait vous aider existe quelque part.
En savoir plusA propos de nous
Apprendre à accéder aux médicaments
En savoir plusQuestions fréquemment posées
En savoir plusComparer les médicaments par maladie
Clause de non-responsabilité
Nous faisons de notre mieux pour assurer l'exactitude, l'actualité et l'exhaustivité des informations fournies ici, mais nous ne pouvons pas les garantir. Les informations sur les médicaments peuvent changer au fil du temps. L'absence d'avertissement pour un médicament donné ou une association de médicaments ne doit pas être interprétée comme une confirmation que ce médicament est sûr, efficace ou adapté à chaque patient. Consultez toujours votre médecin traitant avant de commencer un traitement.
Livraison dans le monde entier
Cliquez sur un pays ci-dessous pour consulter un guide sur l'importation de médicaments dans ce pays.