Tout ce que les patients doivent savoir sur Aduhelm (aducanumab) | New Alzheimer's Medicine
Dernière mise à jour : 15 mars 2022

Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentArticle revu par le Dr. Jan de Witt
Le 7 juin 2021, la FDA a approuvé l'aducanumab (produit sous le nom commercial "Aduhelm") pour le traitement de la maladie d'Alzheimer, suscitant l'espoir de millions de patients atteints de la maladie d'Alzheimer et de leurs familles dans le monde entier, tandis que des experts ont fait part de leurs inquiétudes concernant cette décision.
Aduhelm est le premier médicament contre la maladie d'Alzheimer à être approuvé par la FDA depuis 18 ans. Ce médicament prétend, selon les résultats publiés, être capable de ralentir la progression de la maladie d'Alzheimer elle-même, plutôt que d'en atténuer les symptômes.
La décision de la FDA d'approuver le médicament a suscité de nombreuses controverses. Néanmoins, Biogen, le fabricant d'Aduhelm, prévoit de commencer à expédier Aduhelm à plus de 900 centres de soins de santé aux États-Unis d'ici la fin du mois de juin 2021.
Aduhelm est actuellement disponible pour les patients appropriés en dehors des États-Unis, sur la base d'un usage compassionnel ou d'un patient désigné. Pour en savoir plus, consultez la section "Accès à Aduhelm en dehors des États-Unis".
La maladie d'Alzheimer : une des crises sociales, médicales et économiques majeures du 21e siècle
La maladie d'Alzheimer est une affection cérébrale dégénérative qui touche aujourd'hui plus de 40 millions de personnes dans le monde et constitue la cause la plus fréquente de démence. Considérée pendant de nombreuses années comme un phénomène normal du vieillissement, la maladie d'Alzheimer est aujourd'hui reconnue comme une affection ayant de graves répercussions sur le plan sanitaire, économique et social.
Les chercheurs ne comprennent pas encore parfaitement les causes de la maladie d'Alzheimer, mais on pense qu'elle est due à une combinaison de facteurs, tels que
- Le vieillissement : La maladie d'Alzheimer est le plus souvent diagnostiquée après l'âge de 65 ans (maladie d'Alzheimer tardive). Environ un tiers des personnes âgées de 85 ans et plus sont atteintes de la maladie d'Alzheimer. Les modifications du cerveau liées au vieillissement peuvent contribuer à l'apparition de la maladie.
- Les antécédents familiaux : Le fait d'avoir un membre de la famille au premier degré atteint de la maladie d'Alzheimer augmente le risque de développer la maladie. Les scientifiques pensent qu'une prédisposition génétique peut être à l'origine de la forme précoce de la maladie d'Alzheimer, qui survient chez les personnes âgées de 30 à 60 ans. Seuls 10 % des patients atteints de la maladie d'Alzheimer présentent la forme précoce de la maladie.
- Autres facteurs : Les scientifiques ont établi des liens entre le déclin cognitif et les maladies cardiaques, ainsi que le diabète et l'obésité. Les preuves les plus solides établissent un lien entre la santé du cerveau et la santé du cœur. Les traumatismes crâniens ont également été associés à un risque accru de maladie d'Alzheimer, car ils peuvent déclencher la formation de plaques amyloïdes. Les personnes atteintes du syndrome de Down, dans lequel un chromosome supplémentaire détermine le codage génétique d'un type de protéine amyloïde lié à la maladie d'Alzheimer, présentent également un risque accru.
La majorité des personnes atteintes de la maladie d'Alzheimer sont diagnostiquées au stade léger, lorsque les symptômes deviennent plus prononcés et que la maladie a déjà causé des lésions cérébrales, même si certains symptômes commencent à apparaître dix ans avant le diagnostic. Les symptômes précoces peuvent être ignorés par les patients (souvent par honte) ou simplement ne pas être remarqués par les médecins ou les membres de la famille. Les patients ont une espérance de vie moyenne de 3 à 11 ans après le diagnostic.
"Avec le temps, maman a oublié qui j'étais"
La maladie d'Alzheimer comporte trois stades différents:
- Légère: Dans les premiers stades, les patients subissent des pertes de mémoire telles que l'oubli de dates et d'événements importants, la répétition fréquente de questions, l'allongement du temps nécessaire à l'accomplissement des tâches quotidiennes, des difficultés constantes avec les finances, l'égarement fréquent d'objets et l'anxiété. (Pour en savoir plus sur l'ampleur des pertes de mémoire normales avec l'âge, consultez cette infographie de l'Institut national de la santé (NIH) sur le vieillissement).
- Modérée: Au fur et à mesure que la maladie progresse, les patients présentent des pertes de mémoire et une confusion accrues, des difficultés à communiquer et à lire, des difficultés à accomplir des tâches routinières telles que s'habiller, des difficultés à reconnaître leur famille et leurs amis, de la paranoïa, des hallucinations et de l'errance.
- Sévère: Les patients atteints d'une forme sévère de la maladie d'Alzheimer sont incapables de communiquer, perdent du poids, ont des difficultés à avaler et perdent le contrôle de leurs intestins et de leur vessie. À ce stade, les patients sont alités la plupart du temps et dépendent entièrement des autres pour leurs soins.
Les difficultés rencontrées par les patients atteints de la maladie d'Alzheimer sont considérables, car la maladie a un impact sur tous les aspects de leur vie quotidienne. Vous trouverez ci-dessous quelques récits de patients ou d'amis et de membres de leur famille.
Sandy, ancien dentiste et professeur assistant à Harvard, a expliqué à des journalistes de CNN qu'il s'était rendu compte que son oubli avait évolué vers quelque chose de pire : "Je regarde un dossier dentaire pendant une heure et demie", se souvient-il. Je le lis, il est dans mon cerveau. Puis je refermais le dossier et ne me souvenais littéralement de rien à propos de l'affaire". Peu de temps après, on lui a diagnostiqué la maladie d'Alzheimer.
Fred Walker, dont la femme a été diagnostiquée avec la maladie d'Alzheimer, a parlé de sa femme à Alzheimer's Research UK : "'L'utilisation du téléphone est devenue au-delà de ses capacités. Elle ne pouvait pas maîtriser tous les boutons. La cuisinière était beaucoup trop complexe à comprendre et il y avait toujours le risque qu'elle laisse le gaz allumé. Elle trouvait que faire une tasse de thé était trop compliqué et ne savait plus quelle quantité de thé, de lait et d'eau était nécessaire".
La maladie d'Alzheimer, lorsqu'elle atteint les derniers stades et évolue vers la démence, est décrite par Laury pour la Société Alzheimer :
"[...] nous nous sommes embarqués dans un nouveau voyage. Un voyage qui impliquait des soins 24 heures sur 24, des tournées de médicaments quotidiennes et une maman complètement perdue dans le brouillard de son propre esprit. [...] Ce n'est qu'à ce moment-là que nous avons pris conscience de l'horreur que représentait le fait de voir un être cher atteint de cette maladie cruelle et insidieuse. [...] Elle a commencé à avoir des hallucinations".
Le fondateur de everyone.org , Sjaak Vink, confirme et reconnaît chacune de ces descriptions. Sa mère a été diagnostiquée avec la maladie d'Alzheimer en 2015.
C'est un chemin difficile pour les patients et leurs proches - et la maladie ne se contente pas d'avoir un impact sur leur vie personnelle et celle de leurs proches.
Pression sur les soignants, les budgets et les décideurs politiques
Les patients atteints de la maladie d'Alzheimer ont besoin de soins de plus en plus exigeants au fur et à mesure que leur état se détériore, tels que les soins à domicile, les soins de nuit, les services d'entretien ménager ou les soins infirmiers ; à terme, les patients peuvent avoir besoin de vivre dans des centres d'aide à la vie autonome ou des maisons de soins infirmiers. La maladie fait payer un lourd tribut au patient, aux membres de sa famille (qui se consacrent souvent à sa prise en charge), ainsi qu'à son budget personnel et à celui de l'État.
Les aidants familiaux sont confrontés à une mission difficile lorsqu'ils s'occupent de leurs proches atteints de la maladie d'Alzheimer. Une enquête a révélé que 95 % des aidants familiaux au Royaume-Uni déclarent que cela affecte leur santé physique ou mentale, 69 % se sentent constamment épuisés, 64 % sont anxieux et 49 % sont déprimés.
En Europe, la maladie d'Alzheimer et d'autres formes de démence touchent environ 10 millions de personnes et ce nombre devrait atteindre 14 millions d'ici 2030. Le coût économique de la démence en Europe est estimé à plus de 250 milliards d'euros d'ici 2030, dont plus de 50 % sont dus aux coûts des soins informels. L'accès aux soins et aux traitements est inégal et, en particulier en Europe de l'Est, les systèmes de soutien et les programmes sociaux destinés aux patients atteints de la maladie d'Alzheimer et à leurs aidants sont insuffisants.
Aux États-Unis, la maladie d'Alzheimer est récemment entrée dans la liste des dix premières causes de décès et est la seule à ne pas avoir de remède connu. Elle touche 6 millions de personnes aux États-Unis et ce nombre devrait passer à 12 millions d'ici 2050. D'ici à la fin de 2021, le coût total de la prise en charge des personnes atteintes de la maladie d'Alzheimer et d'autres démences pourrait atteindre 355 milliards de dollars et devrait s'élever à 1,1 billion de dollars d'ici à 2050.
Ce financement, aussi astronomique qu'il puisse paraître, est nécessaire pour offrir aux patients un soutien adéquat et, dans la mesure du possible, une vie digne.
En raison des soins requis 24 heures sur 24, en particulier aux stades avancés, les patients atteints de la maladie d'Alzheimer sont particulièrement affectés lorsque leurs soins sont inadéquats, ce qui est le cas dans de nombreux pays ou communautés. Rien qu'au Royaume-Uni, des dizaines de milliers de personnes atteintes de démence sont admises aux urgences chaque année en raison d'infections, de chutes et de déshydratation résultant de soins insuffisants. Cette situation pèse sur les budgets nationaux de santé.
Au cours de la pandémie de COVID-19, les patients atteints de la maladie d'Alzheimer ont été sévèrement touchés et ont subi un nombre élevé de décès en raison de leur âge, d'autres affections de longue durée et des défis posés par la maladie d'Alzheimer elle-même (par exemple, les troubles de la mémoire et la confusion qui font que les patients ont du mal à suivre les directives visant à prévenir les infections par le COVID-19).
Les patients atteints de la maladie d'Alzheimer hébergés dans des maisons de soins ont également ressenti les conséquences néfastes de cette situation d'une autre manière. En raison de l'insuffisance des soins et de la séparation forcée d'avec leurs proches pour les protéger du COVID-19, la solitude et l'isolement qui en résultent ont encore détérioré leur santé mentale et physique.
Des traitements efficaces de la maladie sont nécessaires pour éviter que les crises sanitaires et économiques n'atteignent de graves proportions.
Les points forts de la recherche sur la maladie d'Alzheimer
En 1910, Emil Kraepelin, un médecin allemand, a baptisé cette affection "maladie d'Alzheimer" en référence au médecin Alois Alzheimer, qui a découvert les caractéristiques pathologiques de la démence présénile chez un patient présentant de profondes pertes de mémoire et des changements psychologiques de plus en plus marqués. La recherche de traitements pour la maladie d'Alzheimer n'a commencé qu'à la fin des années 1980 aux États-Unis, mais elle s'est heurtée à des critiques car les médecins croyaient encore que la maladie d'Alzheimer était une conséquence inévitable du vieillissement.
Aux États-Unis, en 1978, le National Institute on Aging (NIA) et l'Alzheimer's Association se sont associés à Pfizer pour lancer le premier essai clinique d'un médicament destiné à traiter les symptômes de la maladie d'Alzheimer. Le médicament a été approuvé en 1993: Le Cognex (tacrine), selon les résultats publiés, a amélioré les capacités cognitives de certains patients, mais n'a pas empêché la maladie de s'aggraver.
Au cours de la décennie suivante, six autres médicaments ont été approuvés, tous pour traiter les symptômes cognitifs de la maladie d'Alzheimer :
- Aricept (donépézil) : pour traiter les symptômes liés à la mémoire et à la pensée
- Razadyne (galantamine) : pour traiter les symptômes liés à la mémoire et à la pensée
- Exelon (rivastigmine) : pour traiter les symptômes liés à la mémoire et à la pensée
- Namenda (mémantine) : pour améliorer la mémoire, l'attention, la raison, le langage
- Namzaric (mémantine + donépézil) : une combinaison des médicaments ci-dessus.
- Belsomra (Suvorexant) : pour le traitement de l'insomnie chez les patients atteints de la maladie d'Alzheimer
Le dernier médicament approuvé pour le traitement de la maladie d'Alzheimer l'a été en 2003. Pendant des décennies, la maladie d'Alzheimer a été considérée comme une conséquence naturelle du vieillissement. Peu de ressources étaient consacrées à la recherche d'un traitement, car la question de savoir s'il s'agissait d'une véritable maladie était débattue. Au cours des 20 dernières années, cependant, les chercheurs ont consacré beaucoup de ressources à l'étude de la maladie et à la mise au point d'un traitement.
L'absence de traitement de la maladie d'Alzheimer n'est pas due à une négligence de la part des sociétés pharmaceutiques : l'industrie dans son ensemble a investi des milliards dans la recherche. À elle seule, la société Eli Lilly a dépensé 4,2 milliards de dollars en trois décennies pour tenter de mettre au point un médicament efficace, et les National Institutes of Health (NIH) des États-Unis ont consacré plus de 500 millions de dollars par an à la recherche et à la mise au point de traitements.
Depuis 2013, le Congrès américain a triplé le budget annuel des NIH pour le financement de la recherche sur la maladie d'Alzheimer et les démences apparentées, pour atteindre 3,1 milliards de dollars en 2019.
Les financements nationaux et privés ont permis de réaliser 2173 essais cliniques d'ici 2019 pour tester différentes théories. Les principales théories testées :
- 19 % des essais sont axés sur l'hypothèse d'un neurotransmetteur
- 17,0 % des essais ont testé l'hypothèse de la cascade mitochondriale et d'autres hypothèses connexes.
- 12,7 % ont testé l'hypothèse de la propagation du tau
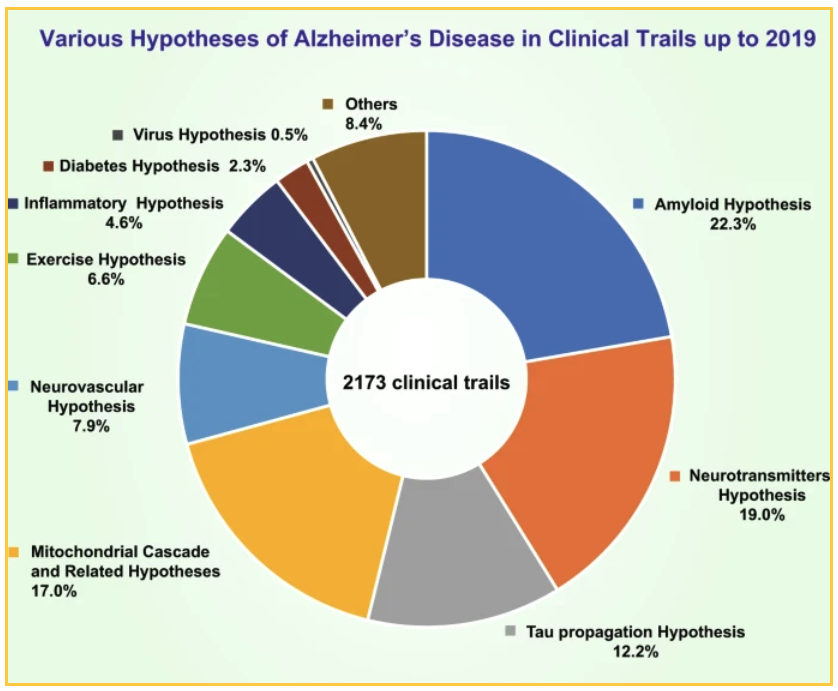
Les 22,3 % d'essais qui ciblent l'amyloïde se concentrent sur différents moyens de réduire la plaque :
- Anticorps générés par le système immunitaire contre la bêta-amyloïde: Les "vaccins actifs" qui, lorsqu'ils sont injectés dans le corps, déclenchent la production par le système immunitaire d'anticorps qui détruisent la bêta-amyloïde et réduisent les niveaux de bêta-amyloïde dans le cerveau.
- Anticorps contre la bêta-amyloïde produits en laboratoire: Les "vaccins passifs", qui sont considérés comme plus efficaces et plus sûrs que d'essayer d'induire la production d'anticorps dans l'organisme.
- Diminution de la production de bêta-amyloïde: Certains traitements expérimentaux modifient le comportement de certaines protéines qui peuvent empêcher ou réduire la production de bêta-amyloïde.
- Prévention de l'agrégation de la bêta-amyloïde: Les scientifiques recherchent des médicaments qui empêchent les interactions initiales entre la bêta-amyloïde et les cellules cérébrales qui conduisent à la mort de la cellule cérébrale.
- Augmenter l'élimination de la bêta-amyloïde: Techniques telles que la mobilisation du système immunitaire pour attaquer la bêta-amyloïde ou l'administration d'agents naturels ayant des effets anti-amyloïdes.
- Agents naturels ayant des effets anti-amyloïdes: L'immunoglobuline intraveineuse (IVIg) obtenue à partir de donneurs de sang humains contient des anticorps naturels qui peuvent réduire les niveaux de bêta-amyloïde.
Qu'est-ce qu'Aduhelm aducanumab-avwa) ?
Aduhelm (aducanumab) est un anticorps anti-amyloïde indiqué dans le traitement de la maladie d'Alzheimer. Il est conçu pour éliminer les plaques de bêta-amyloïde qui se forment entre les cellules du cerveau en quantités anormales chez les patients atteints de la maladie d'Alzheimer, ce qui entraîne la mort des cellules cérébrales affectées. La bêta-amyloïde a été identifiée en 1984 et a rapidement été considérée comme le principal déclencheur de la détérioration des cellules cérébrales, tandis qu'en 1986 a été identifiée la protéine tau, un composant clé des enchevêtrements et un second déclencheur de la détérioration des cellules cérébrales.
Aduhelm a été développé par Biogen, Inc, une société multinationale de biotechnologie basée dans le Massachusetts, aux États-Unis. Aduhelm est administré sous forme d'injection mensuelle.
Aduhelm a une longue histoire.
La société suisse de biotechnologie Neurimmune Therapeutics AG, en collaboration avec l'université de Zurich, a identifié les anticorps anti-amyloïdes protecteurs chez les personnes âgées en bonne santé et les patients atteints de démence à progression lente, ce qui a conduit à la découverte de l'aducanumab, l'ingrédient actif d'Aduhelm. Chez les patients atteints d'une forme légère de la maladie d'Alzheimer, une année de perfusions intraveineuses mensuelles d'aducanumab réduit la plaque amyloïde, ce qui entraîne un ralentissement du déclin cognitif.
En 2007, Neurimmune a concédé à Biogen la licence de l'aducanumab pour le traitement de la maladie d'Alzheimer et travaille en collaboration avec Biogen sur son développement.
Comment fonctionne Aduhelm ?
La maladie d'Alzheimer semble être le résultat de l'accumulation inhabituelle dans le cerveau de deux protéines, la bêta-amyloïde et la protéine tau. La bêta-amyloïde est une protéine normalement présente dans le cerveau qui, dans la maladie d'Alzheimer, s'agglomère en plaques amyloïdes entre les cellules cérébrales - la théorie amyloïde affirme que ces plaques endommagent et finissent par tuer les cellules cérébrales. Les plaques amyloïdes semblent se développer plus tôt dans la maladie, tandis que les enchevêtrements de tau ont tendance à apparaître plus tard dans la maladie. La plupart des recherches menées pour trouver un traitement à la maladie d'Alzheimer se sont concentrées sur l'élimination des plaques amyloïdes.
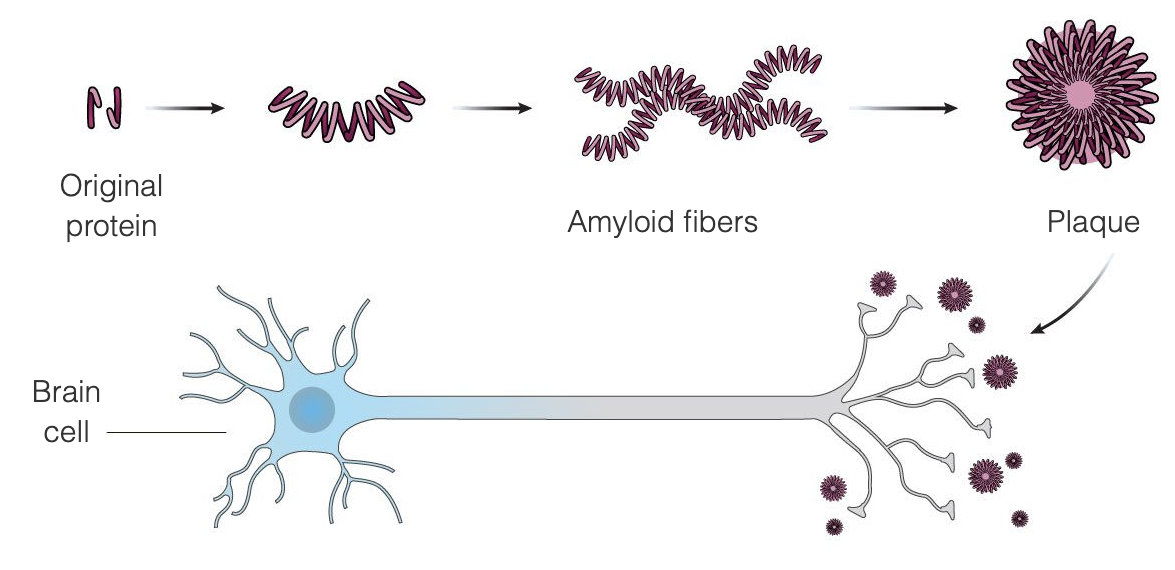
Aduhelm est conçu pour traiter la maladie d'Alzheimer aux tout premiers stades de la maladie en se liant aux plaques amyloïdes, déclenchant ainsi la destruction des plaques par le système immunitaire, qui les considère comme un envahisseur étranger. L'objectif est qu'une fois les plaques éliminées, les cellules cérébrales cessent de mourir et les fonctions cognitives cessent de se détériorer. Aduhelm utilise ce mécanisme dans le but de ralentir la progression de la maladie, en s'adressant plus particulièrement aux patients aux premiers stades de la maladie d'Alzheimer. Aduhelm n'inverse pas les dommages déjà causés.
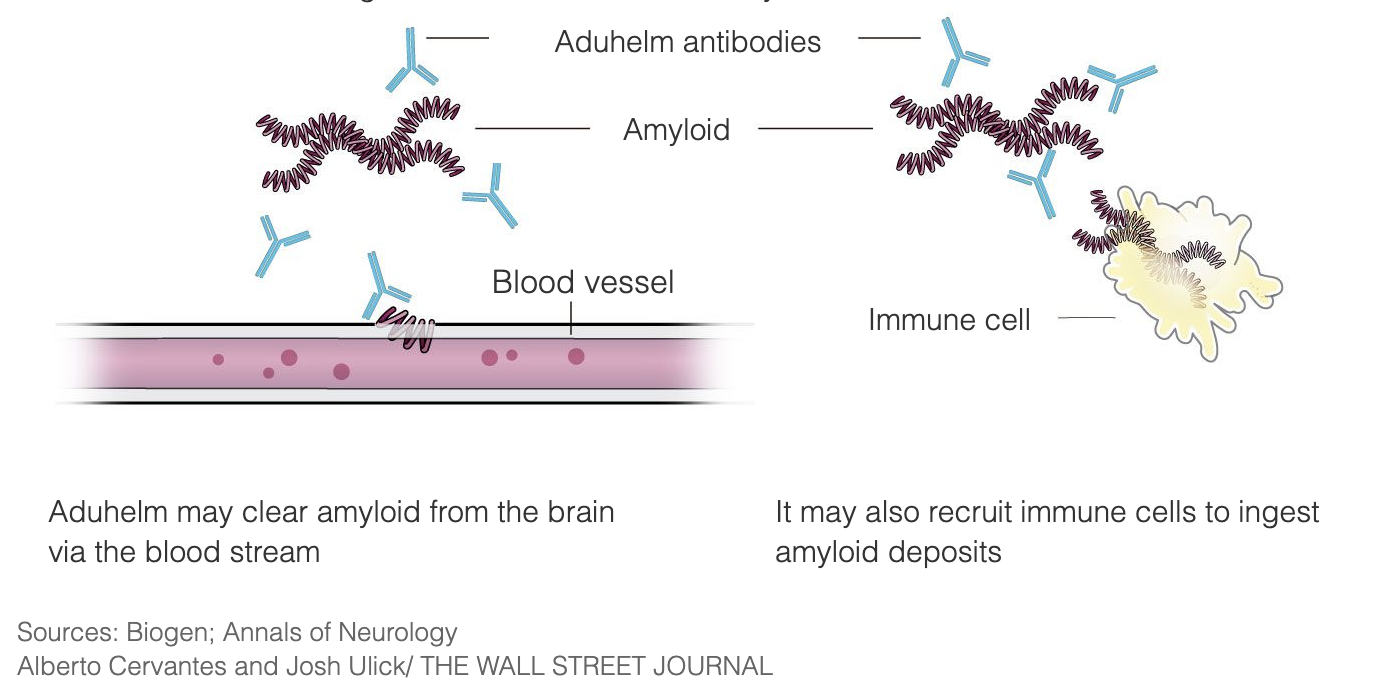
Les plaques amyloïdes sont la cible de la recherche sur la maladie d'Alzheimer et du développement de médicaments depuis trois décennies, et Aduhelm est l'un des traitements qui ont fait l'objet de recherches au fil des ans.
"L'église de la Sainte Amyloïde
Les scientifiques ne sont pas encore d'accord sur les causes de la maladie d'Alzeimer, mais ils ont certaines théories. L'une d'entre elles est appelée "l'hypothèse amyloïde" et l'Aduhelm a été développé sur la base de cette théorie.
L'hypothèse amyloïde affirme que la formation de plaques amyloïdes entre les cellules cérébrales entraîne la mort de ces dernières, ce qui conduit au déclin cognitif. Il s'agit d'une théorie ancienne qui n'a jamais été universellement acceptée, et l'échec des essais cliniques ciblant les plaques amyloïdes a enhardi ses détracteurs. Certains appellent le groupe des partisans de la théorie "l'Église de la Sainte Amyloïde" en raison de leur réticence, voire de leur refus, d'envisager d'autres théories.
Même la fonction normale de la bêta-amyloïde dans le cerveau est contestée par les chercheurs, qui ne s'accordent pas sur le rôle qu'elle joue naturellement dans le corps humain ou si elle est strictement un marqueur de la maladie d'Alzeimer.
Un contre-argument courant à l'hypothèse amyloïde est que l'on trouve des plaques dans le cerveau de nombreuses personnes âgées ayant des facultés cognitives normales. Il est intéressant de noter que certains examens post mortem de personnes âgées de plus de 90 ans ayant une mémoire extraordinaire ont révélé la présence de plaques amyloïdes dans leur cerveau à des degrés divers - certaines d'entre elles avaient une densité si élevée qu'elles ressemblaient aux cas les plus graves de la maladie d'Alzheimer, et elles avaient également beaucoup plus de neurones que les personnes décédées de la maladie d'Alzheimer.
Certains chercheurs pensent que la bêta-amyloïde pourrait en fait avoir un rôle protecteur.
George Perry, neurobiologiste à l'université du Texas à San Antonio, suggère que "l'accumulation de bêta-amyloïde et de tau est en fait une réponse protectrice aux pressions métaboliques liées à l'âge dans la cellule" et qu'elle est particulièrement utile pour réduire le stress oxydatif dans le cerveau (le stress oxydatif augmente avec l'âge, ce qui endommage les cellules).
Plusieurs études ont examiné d'autres causes potentielles de la maladie d'Alzheimer. L'une d'entre elles a été menée par des chercheurs de l'Icahn School of Medicine at Mount Sinai, à New York, qui ont découvert que deux souches d'un virus appelé HHV (de la famille des herpèsvirus) sont présentes en plus grande quantité dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Bien qu'il ne soit pas certain que ces deux virus soient à l'origine de la maladie (il est plus probable que la cause soit la combinaison du virus et d'une certaine variante génétique appelée APOE), les données suggèrent que l 'infection augmente le risque de développer la maladie d'Alzheimer et que les personnes traitées avec des médicaments antiviraux ont dix fois moins de risques de développer la maladie d'Alzheimer.
La théorie de l'amyloïde est toutefois étayée par des découvertes génétiques qui établissent un lien entre les problèmes génétiques liés à l'amyloïde et le développement de la maladie d'Alzheimer à un stade précoce (chez les personnes âgées de 30 à 65 ans). Le syndrome de Down est considéré comme un facteur de risque, car les chercheurs ont découvert que les personnes atteintes du syndrome de Down ont une copie supplémentaire d'un chromosome qui contient le gène codant pour une protéine amyloïde liée à l'apparition précoce de la maladie d'Alzheimer.
D'autres anomalies génétiques peuvent entraîner la production de variantes plus longues de la bêta-amyloïde, qui forment plus facilement des plaques, ou augmenter la production de bêta-amyloïde et provoquer des cas assez rares de maladie d'Alzheimer précoce. Plusieurs membres d'une même famille peuvent être porteurs de ces mutations génétiques et augmenter le risque de développer une forme précoce de la maladie d'Alzheimer.
Les partisans de la théorie amyloïde suggèrent que les essais antérieurs portant sur des médicaments ciblant les plaques amyloïdes étaient tout simplement défectueux. Par exemple, une étude sur le semagacestat, un inhibiteur de la production de protéines bêta-amyloïdes, a détérioré la cognition des participants à l'étude ; les chercheurs ont également observé une augmentation du nombre de cancers de la peau parmi les participants. Cela pourrait être dû au fait que le semagacestat a inhibé la production d'autres protéines, et pas seulement la bêta-amyloïde, dont certaines ont des fonctions importantes dans le corps humain.
L'explication la plus plausible de l'échec de ces essais qui ciblent les amyloïdes est que les médicaments sont les bons, mais qu'ils sont administrés au mauvais moment dans la progression de la maladie d'Alzheimer - ils sont administrés trop tard dans le processus de formation des plaques amyloïdes, un processus qui commence des dizaines d'années avant l'apparition des symptômes.
Michael Murphy, neuroscientifique à l'université du Kentucky, note que "nous disposons probablement déjà d'un médicament qui pourrait traiter la maladie d'Alzheimer, si nous le donnions aux personnes âgées de 50 ans".
Les causes de la maladie d'Alzheimer font l'objet d'un débat important et les experts ne sont pas encore unanimes, mais les patients et les chercheurs ont trouvé un nouveau souffle grâce aux résultats obtenus par l'aducanumab dans l'un des essais cliniques de phase 3 d'Aduhelm.
Aduhelm en essais cliniques
Les essais cliniques se déroulent en quatre phases:
- Phase 0: le médicament est testé en très petites quantités sur moins de 15 participants afin de s'assurer qu'il n'est pas nocif et que l'essai peut se poursuivre.
- Phase 1: le médicament est testé sur 20 à 80 participants ne présentant pas de problèmes de santé sous-jacents, afin de s'assurer qu'il n'y a pas d'effets secondaires graves. Selon la FDA, environ 70 % des médicaments passent en phase 2.
- Phase 2: le médicament est testé sur plusieurs centaines de participants souffrant de la pathologie pour laquelle il est prévu, pendant quelques mois ou quelques années, afin de recueillir des informations sur son efficacité et ses effets secondaires. Environ 33 % des médicaments passent à la phase 3.
- Phase 3: le médicament est testé sur un maximum de 3 000 participants souffrant de la pathologie pour laquelle le médicament est prévu, et cette phase peut durer plusieurs années. La sécurité et l'efficacité du médicament doivent être prouvées. 25 à 30 % des médicaments passent à la phase 4.
- Phase 4: cette phase implique des milliers de participants sur plusieurs années et a lieu après l'approbation du médicament par la FDA. Elle a pour but de recueillir davantage d'informations sur la sécurité et l'efficacité à long terme du médicament.
Aduhelm en phase 1
Biogen a mené plusieurs essais cliniques sur l'aducanumab, en commençant par trois essais de phase 1 en 2011 qui ont testé l'aducanumab sur des volontaires sains et des patients atteints de la maladie d'Alzheimer aux États-Unis et au Japon, en travaillant avec différentes doses d'aducanumab et de placebo. Certains patients ont été recrutés pendant plus de trois ans.
En 2016, Biogen a publié les résultats de son essai clinique de phase 1, dans lequel les chercheurs ont administré des perfusions intraveineuses mensuelles d'aducanumab pendant un an à des participants à l'essai atteints d'une forme légère de la maladie d'Alzheimer. Les participants traités par l'aducanumab ont présenté une réduction des niveaux de bêta-amyloïde dans le cerveau et un ralentissement du déclin cognitif, mesuré par une évaluation officielle de la démence clinique. Parmi les participants ayant reçu des perfusions d'aducanumab, les chercheurs de Biogen ont également enregistré une réduction des effets secondaires tels que les ARIA (anomalies d'imagerie liées à l'amyloïde, par exemple œdème cérébral ou hémorragie dans le cerveau). Biogen a jugé ces résultats suffisamment encourageants pour passer à la phase 2.
Aduhelm en phase 2
Biogen a commencé les essais de phase 2 fin 2018 et a évalué la sécurité d'un dosage continu d'aducanumab, en plus de vérifier une réduction des plaques amyloïdes et un ralentissement du déclin cognitif chez les participants atteints de la maladie d'Alzheimer à un stade précoce et symptomatique.
L'aducanumab n'a pas atteint son objectif principal, qui était de ralentir le déclin cognitif au bout de 12 mois, mais après une réanalyse des données de l'essai sur 18 mois, des effets positifs ont été observés pour l'une des cinq doses, la plus élevée. La dose la plus élevée a permis de réduire les plaques amyloïdes dans le cerveau et de montrer des réponses positives sur la cognition.
Des effets secondaires ont été observés, comme dans la phase 1, tels que des ARIA (anomalies d'imagerie liées à l'amyloïde) chez environ 10 % de l'ensemble des participants, et moins de 15 % chez les participants ayant reçu les doses les plus élevées d'aducanumab.
"Les résultats à 18 mois de l'essai BAN2401 sont impressionnants et apportent un soutien important à l'hypothèse amyloïde, a déclaré Jeff Cummings, directeur fondateur du Cleveland Clinic Lou Ruvo Center for Brain Health, dans un communiqué pour Biospace.
Aduhelm en phase 3
Après les résultats de l'essai de phase 2, Biogen a mené deux essais de phase 3, appelés Engage et Emerge, auxquels ont participé près de 3 300 personnes atteintes d'une forme relativement légère de la maladie d'Alzheimer en Amérique du Nord, en Australie, en Europe et en Asie. L'aducanumab a été administré une fois par mois à des doses faibles et élevées par injection dans le sang et a été comparé aux résultats des participants ayant reçu un placebo.
En mars 2019, Biogen a interrompu les deux études de phase 3, citant une analyse de futilité menée par un comité indépendant de surveillance des données qui a conclu que l'aducanumab ne semblait pas fonctionner comme prévu.
Cette décision concerne 3 300 participants à l'étude. Les protocoles de participation à l'étude impliquaient des visites fréquentes et prolongées et comprenaient des prises de sang, des IRM, des TEP et parfois des ponctions lombaires. Sept mois après l'arrêt des deux études, Biogen a annoncé qu'une nouvelle analyse des données supplémentaires indiquait qu'à fortes doses, le médicament semblait réduire le déclin cognitif.
Biogen a écrit dans un communiqué de presse que les données supplémentaires consistent en des résultats d'un sous-ensemble de patients de l'étude de phase 3 Engage qui ont reçu une dose élevée d'aducanumab et ont connu une réduction significative des déficiences cognitives et fonctionnelles (mémoire, orientation, langage), ainsi que des avantages pour les activités de la vie quotidienne (faire des tâches ménagères, faire des courses, se déplacer de manière autonome en dehors de la maison). Sur la base de ces résultats, Biogen a déposé une demande d'autorisation réglementaire pour l'aducanumab en octobre 2019 et l'a reçue début juin 2021.
Bien que les essais cliniques de phase 3 n'aient pas été totalement concluants quant aux bénéfices du traitement sur la cognition et les fonctions, la FDA a conclu que les essais démontraient que l'aducanumab, produit sous le nom commercial Aduhelm, pouvait réduire les plaques amyloïdes, ce qui a constitué la base de la décision d'approbation accélérée de la FDA.
Phil Gutis, participant à l'essai et journaliste , a écrit sur la plateforme d'information Being Patient : "J'ai appris, grâce à une étude longitudinale par TEP, que je n'avais plus d'amyloïde dans mon cerveau. Ce scanner, réalisé il y a environ deux ans dans le cadre de l'étude Aging Brain Cohort au Penn Memory Center, a confirmé ce que je pressentais de plus en plus, à savoir que l'aducanumab m'aidait effectivement. J'ai commencé à sentir que je sortais d'un brouillard mental constant... Du côté négatif, les souvenirs que j'avais perdus ne sont pas revenus".
Effets secondaires et contre-indications d'Aduhelm
Selon le guide des médicaments de Biogen, avant d'envisager l'utilisation d'Aduhelm, les patients doivent informer leurs fournisseurs de soins de santé de toutes leurs conditions médicales, y compris s'ils.. :
- sont enceintes ou prévoient de l'être
- vous allaitez ou envisagez d'allaiter
Les patients doivent informer leur médecin de tous les médicaments qu'ils prennent, y compris les médicaments délivrés sur ordonnance ou en vente libre, les vitamines et les compléments alimentaires à base de plantes.
Selon le guide des médicaments de Biogen, le principal effet secondaire connu d'Aduhelm est l'ARIA (anomalies d'imagerie liées à l'amyloïde), comme l'œdème cérébral et les saignements dans le cerveau. Les autres effets secondaires sont les suivants :
- des réactions allergiques graves, telles qu'un gonflement du visage, des lèvres, de la bouche ou de la langue et de l'urticaire
- maux de tête
- diarrhée
- confusion/délire/altération de l'état mental/désorientation
- chutes
L'ARIA est un effet secondaire courant qui ne provoque généralement aucun symptôme, mais qui peut être grave. Il se manifeste le plus souvent par un gonflement temporaire du cerveau qui disparaît généralement de lui-même avec le temps. En même temps, l'élimination de l'amyloïde du cerveau élimine également l'amyloïde des vaisseaux sanguins, ce qui peut créer de petites taches de saignement à l'intérieur ou à la surface du cerveau.
Une ARIA a été observée chez 41 % des participants aux essais cliniques ayant reçu l'aducanumab, contre 10 % des participants ayant reçu un placebo.
Bien que la plupart des personnes souffrant d'un gonflement de certaines zones du cerveau ne présentent aucun symptôme, environ 30 % d'entre elles peuvent présenter des symptômes légers, tels que
- confusion
- maux de tête
- vertiges
- changements de vision
- nausées
Daniel Gibbs, neurologue à la retraite et participant de longue date aux essais cliniques d'Aduhelm , a fait part de son expérience d'un effet secondaire extrêmement rare d'ARIA:
"Je dois dire tout d'abord, et c'est le dogme qui est largement vrai, que [les ARIA] sont généralement bénignes. La plupart des gens ne savent pas qu'ils en sont atteints. [Les ARIA ne sont détectées qu'à l'IRM, où l'on observe de petites zones de gonflement ou de minuscules zones de dépôt de fer dues à des saignements. Les symptômes éventuels sont généralement bénins. Les maux de tête sont les plus fréquents, et parfois la confusion.
Mais presque toujours, même en cas d'ARIA symptomatique, si vous arrêtez le médicament, les symptômes disparaissent en quelques mois. Le médicament peut être repris en toute sécurité. Il y a eu très peu de cas, du moins ceux qui ont été discutés par le fabricant du médicament Biogen, d'ARIA catastrophiques ou graves, et le mien faisait partie de cette catégorie. [...]
J'ai commencé à avoir de plus en plus de maux de tête. Les maux de tête n'étant pas rares, je n'y ai pas vraiment pensé, mais ils sont devenus un peu plus fréquents et peut-être un peu plus sévères, mais toujours soulagés par des [médicaments] en vente libre. [...]
Puis, une nuit ou deux avant Noël 2017, j'ai eu le pire mal de tête de ma vie, le genre que les neurologues associent à une hémorragie sous-arachnoïdienne, une hémorragie massive dans le cerveau. J'ai pris ma tension artérielle et elle était très élevée et l'est restée, si bien que j'ai pensé que j'avais un accident vasculaire cérébral.
J'ai demandé à ma femme de m'emmener aux urgences, et lorsque je suis arrivé à l'hôpital local, je n'étais vraiment pas en mesure de raconter une histoire cohérente. [...]
Mais au bout de quelques jours, j'allais un peu mieux. Mon mal de tête avait disparu, mais j'avais toujours du mal à lire. Au cours du mois suivant, la situation s'est un peu aggravée. Mes examens IRM ont alors montré qu'il s'agissait d'un ARIA, avec un gonflement et un saignement dans tout le cerveau. Comme la maladie s'aggravait, on a estimé qu'il fallait la traiter. J'ai reçu cinq doses de stéroïdes à haute dose qui ont immédiatement soulagé les maux de tête et la confusion. Mais il a fallu environ six mois pour que le gonflement de mon cerveau disparaisse complètement.
Compte tenu de ces effets secondaires potentiels rares mais graves, les prestataires de soins de santé des patients devront effectuer des examens d'imagerie par résonance magnétique (IRM) avant et pendant le traitement par Aduhelm afin de vérifier la présence d'ARIA.
Approbation d'Aduhelm (aducanumab)
Le 7 juin 2021, la FDA a accordé une autorisation accélérée à Aduhelm (aducanumab) pour le traitement de la maladie d'Alzheimer.
L'autorisation accélérée est un type d'autorisation qui peut être accordée aux médicaments qui présentent un effet thérapeutique positif lors d'essais cliniques, avant que toutes les preuves concluantes n'aient été présentées. Cela ne peut s'appliquer qu'aux médicaments destinés à traiter des maladies graves et qui répondent à un besoin médical non satisfait ; le dernier médicament approuvé pour le traitement de la maladie d'Alzheimer l'a été il y a plus de 18 ans.
L'autorisation accélérée est accordée sous conditions. La FDA demande au fabricant, Biogen, de mener un nouvel essai clinique pour vérifier les bénéfices cliniques du médicament. Si l'essai ne montre pas de bénéfices, la FDA pourrait retirer l'approbation du médicament. Biogen a jusqu'en 2029 pour réaliser un autre essai clinique afin de confirmer les bénéfices de l'aducanumab pour les patients atteints de la maladie d'Alzheimer ; les experts estiment qu'un troisième essai clinique, qui pourrait être réalisé en deux ans, aurait été une meilleure option que d'attendre huit ans pour savoir si le médicament est efficace, alors que les patients subissent un traitement coûteux et espèrent le meilleur.
Une controverse médicale à connotation financière
La décision de la FDA d'approuver l'aducanumab a laissé perplexes les experts qui estiment qu'il n'y a pas suffisamment de preuves qu'Aduhelm est un traitement efficace de la maladie d'Alzheimer. Nombre d'entre eux, y compris un groupe indépendant, ont informé la FDA que les données disponibles soulevaient des doutes importants quant à la capacité de l'aducanumab à ralentir le déclin cognitif et se sont demandés si les résultats positifs d'une seule des deux études de phase 3 constituaient une base suffisante pour obtenir l'approbation de la FDA.
Peu après l'approbation, trois scientifiques ont démissionné en signe de protestation du comité indépendant qui a conseillé la FDA sur le traitement, en invoquant le manque de preuves convaincantes. Ils ont également critiqué la décision de la FDA d'approuver l'aducanumab pour toute personne atteinte de la maladie d'Alzheimer, bien que l'essai ait été mené à un stade précoce de la maladie, et l'acceptation de la théorie selon laquelle la réduction de la plaque amyloïde ralentirait effectivement les symptômes cognitifs (malgré le désaccord de la communauté scientifique sur sa validité).
La décision de la FDA d'approuver l'aducanumab dans ces conditions pourrait avoir plusieurs conséquences.
- D'autres médicaments ciblant les plaques amyloïdes, comme le donanemab d'Eli Lilly, pourraient être approuvés plus rapidement que prévu, ce qui inciterait les entreprises pharmaceutiques à investir dans des médicaments contre la maladie d'Alzheimer ou à poursuivre leur participation aux essais en cours.
- La décision de la FDA a donné l'impression d'une souplesse réglementaire qui pourrait inciter d'autres sociétés de biotechnologie à développer des médicaments pour des maladies rares, une dynamique qui s'est essoufflée après une longue série d'échecs des essais cliniques, en particulier au cours des 18 années qui se sont écoulées entre l'approbation des traitements contre la maladie d'Alzheimer et leur mise sur le marché.
- Le médicament est assez coûteux (56 000 dollars par an), ce qui signifie que les tarifs des assurances privées pourraient augmenter, car les assureurs devront le prendre en charge, et que la charge pesant sur les contribuables dans le cadre de Medicare (l'assurance maladie nationale des États-Unis) sera plus lourde. Certains affirment que ce traitement pourrait être "dévastateur" pour Medicare, non seulement en raison de ses coûts de base, mais aussi parce que le traitement par Aduhelm exige que les patients soient diagnostiqués plus tôt par des ponctions lombaires pour détecter l'amyloïde et une surveillance constante par IRM (entre autres), ce qui augmente considérablement les coûts et exerce une pression sur les systèmes médicaux.
L'approbation est également considérée comme une aubaine pour Biogen, dont les actions ont augmenté de plus de 50 %, tandis que celles de son partenaire japonais Eisai Co ont grimpé de 56 %. Selon les analystes, l'Aduhelm pourrait potentiellement rapporter quelque 10 milliards de dollars de chiffre d'affaires, sachant que 6 millions de personnes sont atteintes de la maladie d'Alzheimer rien qu'aux États-Unis. Ce médicament est important pour la croissance de Biogen, car la concurrence a nui aux ventes de ses médicaments - Tecfidera pour la sclérose en plaques (SEP) et Spinraza pour l'amyotrophie spinale (SMA).
Spinraza est un autre médicament du portefeuille de Biogen dont le prix est élevé : 750 000 dollars pour la première année de traitement et 375 000 dollars par an par la suite.
La décision de la FDA d'approuver l'Aduhelm ne fait pas l'unanimité
La maladie d'Alzheimer étant une maladie évolutive, les patients ont besoin d'un traitement le plus tôt possible. La décision de la FDA a redonné espoir à de nombreuses personnes, soit que le traitement fonctionne pour elles-mêmes ou pour leur proche, soit qu'il incite d'autres entreprises à développer d'autres traitements contre la maladie d'Alzheimer.
Les groupes de défense des patients avaient vigoureusement insisté pour que le médicament soit approuvé, car il n'existe que six autres traitements pour cette maladie débilitante, qui n'atténuent les symptômes que pendant quelques mois. En novembre 2020, le comité consultatif de la FDA a voté contre l'approbation de l'Aduhelm, ce qui a suscité la colère puis l'action de l'Alzheimer's Association, qui a fait campagne pour exprimer son soutien au potentiel du médicament et souligner la nécessité de l'espoir et du progrès.
En janvier 2021, la FDA et des groupes de patients se sont réunis lors d'une séance d'écoute au cours de laquelle des patients, des soignants, des cliniciens et des défenseurs se sont prononcés en faveur du traitement, arguant notamment du fait que les patients ne peuvent pas se permettre d'attendre plus longtemps un traitement.
Peter Stein, directeur de l'Office of New Drugs de la FDA, a confirmé lors d'une conférence de presse que les opinions des patients avaient joué un rôle. Il a déclaré que la FDA "a entendu très clairement les patients dire qu'ils étaient prêts à accepter une certaine incertitude pour avoir accès à un médicament qui pourrait apporter un bénéfice significatif dans la prévention de la progression de cette maladie, qui, comme nous le savons tous, peut avoir des conséquences très dévastatrices".
Patrizia Cavazzoni, directrice par intérim du Centre d'évaluation des médicaments et de recherche de la FDA, a déclaré lors de la même conférence de presse que "les données confirment que les patients et les soignants ont le choix d'utiliser ce médicament".
"Cette autorisation de mise sur le marché de la FDA marque le début d'une nouvelle ère dans le traitement et la recherche sur la maladie d'Alzheimer", a déclaré Maria Carrillo, Ph.D., directrice scientifique de l'Alzheimer's Association. "L'histoire nous a montré que l'approbation du premier médicament d'une nouvelle catégorie revigore le domaine, augmente les investissements dans les nouveaux traitements et encourage une plus grande innovation.
Quand Aduhelm sera-t-il autorisé en Europe ?
La maladie d'Alzheimer s'impose rapidement comme l'une des principales crises médicales, économiques et sociales du siècle. Elle est difficile à détecter à un stade précoce, surtout si l'on considère le manque de spécialistes en Europe capables de confirmer un diagnostic. Rien qu'en Europe, en 2018, 9,7 millions de personnes souffraient de la maladie d'Alzheimer et d'autres formes de démence ; d'ici à 2030, le nombre de patients devrait atteindre 14 millions, ce qui crée un besoin urgent de traitements efficaces.
Aduhelm n'a pas encore été approuvé en dehors des États-Unis. Biogen a déposé une demande d'examen réglementaire dans l'Union européenne en octobre 2020, ainsi qu'au Japon, au Canada, en Australie et au Brésil à la fin de l'année 2020.
Selon l'Agence européenne des médicaments (EMA), l'évaluation d'une demande d'autorisation de mise sur le marché d'un nouveau médicament prend généralement environ un an, moins si le développeur du médicament bénéficie d'une évaluation accélérée.
En mars de cette année, le site de production de Biogen en Suisse, d'une valeur de 2 milliards de dollars, a reçu une licence de bonnes pratiques de fabrication (BPF) de l'Institut suisse des produits thérapeutiques (Swissmedic). Biogen prévoit de demander à la FDA l'autorisation de produire Aduhelm dans l'usine suisse à la fin de 2021 et espère fournir le médicament à plus d'un million de patients par an.
Accès à Aduhelm en dehors des États-Unis
Aduhelm est actuellement approuvé par la FDA et disponible pour les résidents des États-Unis - et il existe des réglementations qui permettent d'importer des médicaments dans des pays où ils ne sont pas encore approuvés.
Les patients atteints de maladies mortelles ou débilitantes ont le droit d'accéder aux médicaments, de les acheter et de les importer avec l'aide de leur médecin traitant.
Les patients et leurs médecins peuvent le faire sur la base d'un usage compassionnel ou d'un règlement relatif à l'importation de patients désignés, une exception légale à la règle générale selon laquelle un médicament ne peut normalement être accessible qu'après autorisation de mise sur le marché/approbation (quel que soit le terme utilisé) dans le pays où vit le patient. Cette exception permet aux patients d'accéder et d'obtenir, de manière légale, éthique et sûre, des médicaments qui n'ont pas encore été approuvés dans leur pays.
Pour en savoir plus sur la "base du patient désigné" , cliquez ici (EMA).
everyone.org s'engage à ce que les patients et leurs médecins traitants puissent avoir accès à tous les médicaments disponibles dans le monde entier pour le meilleur traitement possible. Nous fonctionnons à 100 % dans le respect des réglementations en vigueur dans votre pays si vous n'êtes pas aux États-Unis. Si vous souhaitez lire plus de détails, accéder au médicament ou contacter notre équipe d'assistance , vous pouvez le faire ici.
Combien coûte Aduhelm ?
Biogen a annoncé que le coût d'Aduhelm à la dose d'entretien (10 mg/kg) pour un patient moyen serait de 56 000 dollars par an. Ce montant n'inclut pas les tests que les patients doivent effectuer avant et pendant le traitement.
Biogen a été critiqué pour le prix élevé du médicament par an.
L'institut à but non lucratif Institute for Clinical and Economic Review (ICER), qui analyse les prix des médicaments, a indiqué qu'un prix annuel équitable se situerait entre 2 500 et 8 300 dollars par patient chaque année. Dans un communiqué, l'ICER a déclaré que l'approbation de la FDA ne protégeait pas les patients et que Biogen pourrait percevoir plus de 50 milliards de dollars par an "même en attendant que des preuves confirment que les patients bénéficient réellement du traitement".
Le PDG de Biogen, Michel Vounatsos, a répondu aux critiques en affirmant que le prix du médicament est justifié par la valeur qu'il apportera aux patients et à une société moins accablée par la maladie d'Alzheimer, et que ce prix est le reflet de "deux décennies d'absence d'innovation". "Ilest temps d'investir dans le traitement", a-t-il ajouté.
Chez everyone.org, nous ne pouvons pas influencer le prix fixé par Biogen. Nous pouvons aider les patients à accéder à Aduhelm aux prix suivants :
- 1 958,58 € pour un flacon de 170 mg/1,7 ml (100 mg/ml)
- €3,046.68 pour un flacon de 300 mg/3 mL (100 mg/mL)
Faites une demande ici pour plus d'informations.
Traitements à venir pour la maladie d'Alzheimer
Une étude publiée en mai 2021 montre qu'il existe actuellement 126 traitements dela maladie d'Alzheimer en cours d'essais cliniques. 82,5 % d'entre eux visent à modifier la maladie, 10,3 % à améliorer la cognition et 7,1 % à soulager les symptômes neuropsychiatriques.
- Essais de phase 3 : 28 traitements (dont l'aducanumab)
- Essais de phase 2 : 74 traitements
- Essais de phase 1 : 24 traitements
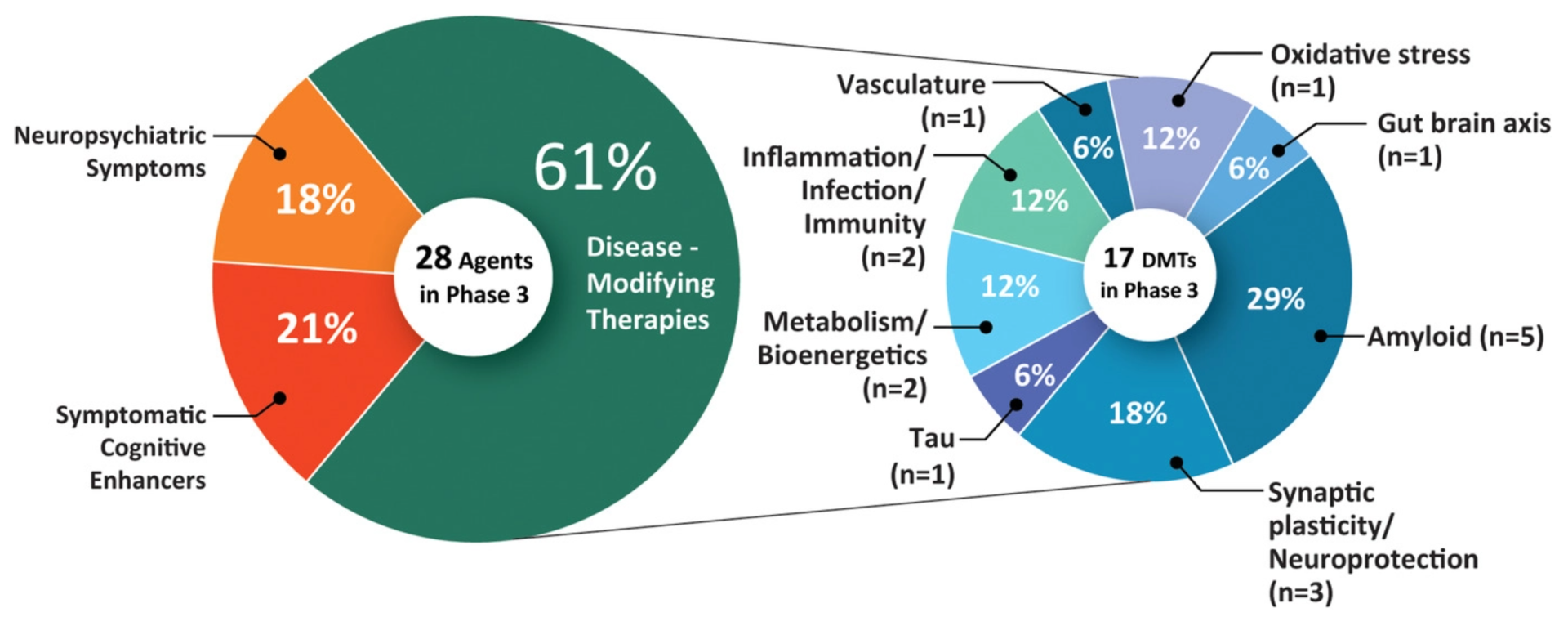
Les traitements faisant l'objet d'essais de phase 3 sont les plus susceptibles d'être approuvés au cours de l'année à venir.
Lecanemab
Fonctionnant de la même manière que l'aducanumab (déclenchement de l'élimination des plaques bêta-amyloïdes par le système immunitaire), l'anticorps monoclonal lecanemab est prometteur, selon les rapports publiés, et est entré dans la phase 3 des essais cliniques.
Gantenerumab
Le gantenerumab se lie à la bêta-amyloïde, en particulier aux plaques de bêta-amyloïde par rapport à la bêta-amyloïde individuelle qui circule dans le sang. On pense qu'il dissout les plaques amyloïdes et élimine la bêta-amyloïde en stimulant la phagocytose, un processus par lequel une cellule absorbe une certaine molécule et la digère. Des études cliniques antérieures sur le gantenerumab ont montré qu'il réduisait les plaques de bêta-amyloïde chez les personnes atteintes de la forme la plus courante de la maladie d'Alzheimer, qui n'est pas directement causée par des mutations génétiques. Le gantenerumab continue d'être étudié dans le cadre de deux grandes études mondiales de phase III.
Solanezumab
Le solanezumab est un anticorps qui vise à "nettoyer" la bêta-amyloïde du sang et du liquide céphalo-rachidien, empêchant ainsi la formation de plaques. Des bénéfices ont été rapportés chez les participants qui ont pris part à l'ensemble des trois ans et demi d'essais, et moins chez les participants qui ont rejoint l'étude plus tard, de sorte qu'il reste encore à apprendre sur les effets de ce médicament.
Donanemab
Le donanemab semble être un autre médicament prometteur pour le traitement de la maladie d'Alzheimer. Il est actuellement testé par Eli Lilly and Company, qui prévoit de recruter 1 500 participants dans le cadre d'une vaste étude afin de confirmer les résultats d'une étude plus restreinte. Cette dernière a duré 76 semaines et a inclus 257 patients ; selon les rapports, elle a montré que le donanemab ralentissait de manière significative l'évolution de la maladie d'Alzheimer.
Autres
Le saracatinib est un composé expérimental qui agit comme un inhibiteur d'une protéine appelée Fyn kinase qui favorise la formation de plaques bêta-amyloïdes. Une étude menée sur des souris a montré que le saracatinib, en inhibant la kinase Fyn, était efficace pour inverser la perte de mémoire chez les souris. L'inhibition de la kinase Fyn peut prévenir ou retarder la progression de la maladie.
Des chercheurs du Salk Institute for Biological Studies, en Californie, étudient une substance chimique appelée fisétine et ont mis au point une version de la fisétine appelée CMS121, qui s'est révélée efficace pour ralentir la perte de cellules cérébrales. D'autres recherches sont nécessaires avant qu'un médicament ne soit prêt à être approuvé.
En ce qui concerne la récente approbation de l'Aduhelm, Maria Carrillo, responsable scientifique de l'association de défense des patients Alzheimer's Association à Chicago (États-Unis), a déclaré dans un communiqué pour Nature : "Nous sommes pleins d'espoir et c'est le début, à la fois pour ce médicament et pour de meilleurs traitements de la maladie d'Alzheimer.
"Tout ce que nous sommes vraiment, ce sont nos pensées et notre cerveau. - Sandy, ancien dentiste, professeur assistant et patient atteint de la maladie d'Alzheimer.
À everyone.org, nous sommes convaincus que la science fait progresser l'humanité et permet d'améliorer, voire de sauver des vies. La maladie d'Alzheimer met en péril la qualité de vie de nombreuses personnes. Nous encourageons les scientifiques qui se consacrent à la recherche d'une (partie de la) solution à persévérer et nous attendons avec impatience que les traitements en cours de développement qui donnent des résultats prometteurs soient approuvés et deviennent accessibles aux patients atteints de la maladie d'Alzheimer dans le monde entier au cours des trois prochaines années.