Quelle est la différence entre Leqembi et Aduhelm? Un aperçu simple.
Dernière mise à jour : 19 novembre 2024
Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentDepuis 2021, la FDA a accordé une autorisation accélérée à deux nouveaux médicaments contre la maladie d'Alzheimer. Il s'agit des thérapies anti-amyloïdes Leqembi (lecanemab) et Aduhelm (aducanumab). Ces deux approbations sont intervenues après près de 20 ans sans percée majeure dans le traitement de la maladie d'Alzheimer. Pour cette raison, les deux médicaments ont fait l'objet d'une grande attention de la part des médias.
L'accueil a toutefois été mitigé. Maria Carrillo, directrice scientifique de l'Alzheimer's Association, a qualifié l'approbation des nouveaux médicaments d'"étape importante pour les personnes éligibles à ce traitement" [2]. Dans le même temps, leur processus d'approbation a été entouré de controverses, en particulier dans le cas d'Aduhelm [1, 4].
En tant que patient, vous vous demandez probablement quelle est la différence entre Leqembi (lecanemab) et Aduhelm (aducanumab). Dans cet article, nous allons comparer les deux médicaments sur leur mode d'action, leur efficacité, ainsi que leur coût et leur disponibilité.
Leqembi vs Aduhelm: A quoi servent-ils ?
Les deux médicaments sont des traitements de la maladie d'Alzheimer à un stade précoce. Ce sont des thérapies anti-amyloïdes qui ciblent les plaques amyloïdes dans le cerveau.
Selon leur notice, Leqembi et Aduhelm sont destinés aux patients souffrant de troubles cognitifs légers et présentant des taux élevés de bêta-amyloïde confirmés [5].
Leqembi vs Aduhelm: Comment fonctionnent-ils ?
Similitudes
Leqembi (lecanemab) et Aduhelm (aducanumab) sont tous deux des anticorps monoclonaux. Ils sont conçus pour cibler les plaques de bêta-amyloïde qui s'accumulent dans le cerveau des patients atteints de la maladie d'Alzheimer. On pense que ces plaques contribuent au déclin cognitif et au déclin clinique observés dans cette maladie.
Les deux médicaments se lient aux plaques amyloïdes et les neutralisent, dans le but de ralentir la progression de la maladie. C'est ce qui différencie fondamentalement Leqembi et Aduhelm des traitements antérieurs de la maladie d'Alzheimer, tels que la galantamine, la rivastigmine et le donépézil. Ces traitements précédents se concentrent sur l'atténuation des symptômes de la maladie. Leqembi et Aduhelm visent à modifier l'évolution de la maladie en ciblant sa cause profonde.
Différences
Leqembi et Aduhelm se lient à des parties différentes de la protéine bêta-amyloïde. Aduhelm se lie plus fortement aux plaques amyloïdes plus grandes et durcies. Leqembi ciblerait mieux la forme plus petite et soluble (et plus toxique) de la protéine amyloïde [6].
Quelle est l'efficacité de Leqembi et d'Aduhelm?
L'efficacité de Leqembi (lecanemab) et d'Aduhelm(aducanumab) a été étudiée dans le cadre d'essais cliniques.
-
Résultats des essais cliniques de Leqembi
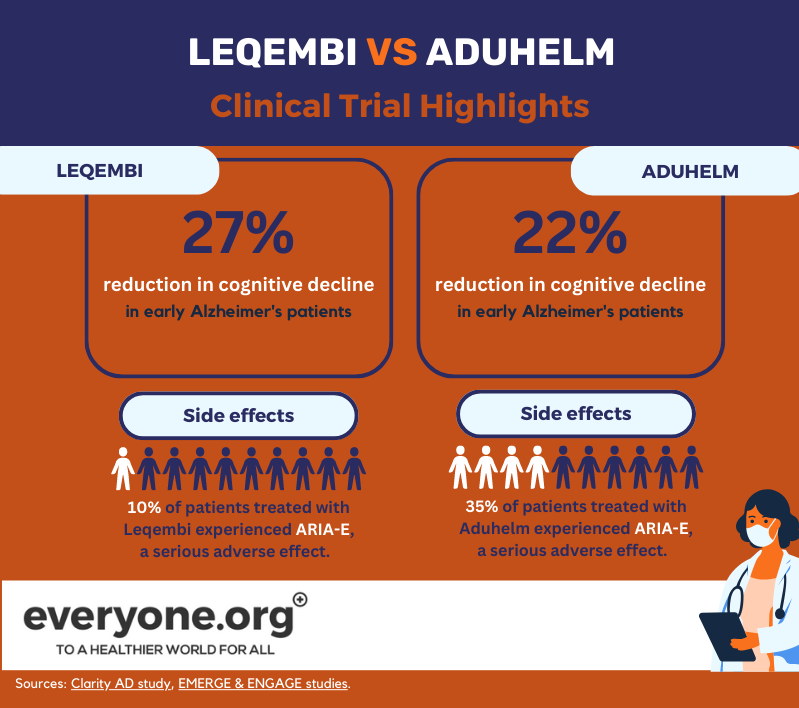
L'approbation accélérée de Leqembi par la FDA est basée sur les résultats positifs de l'étude de phase 3 Clarity AD. Selon ces résultats, Lecanemab a ralenti le déclin cognitif jusqu'à 27 % chez les patients atteints de la maladie d'Alzheimer à un stade précoce, par rapport au placebo. Ces résultats ont été mesurés 18 mois après le début du traitement [8].
Une analyse complémentaire des résultats de l'étude a été publiée en avril 2023. Elle a montré que même après avoir arrêté de prendre Leqembi pendant une période de 9 à 59 mois, les patients continuaient à bénéficier d'un retard dans le déclin cognitif. Au cours de cette " période de latence ", la maladie d'Alzheimer semblait progresser à un rythme toujours plus lent chez les patients ayant reçu Leqembi dans l'essai clinique initial, par rapport à ceux ayant reçu un placebo [7].
L'effet indésirable grave ARIA-E est survenu chez 10 % des patients traités par Leqembi. 6 % des patients de l'essai ont présenté une ARIA-H, un autre effet indésirable grave [13].
-
Résultats des essais cliniques d'Aduhelm
La FDA a accordé son autorisation accélérée à Aduhelm sur la base de deux essais cliniques de phase 3. L'un d'entre eux (EMERGE) a montré une réduction du déclin clinique des patients allant jusqu'à 22 % [12]. L'autre (ENGAGE) ne l'a pas fait. Dans les deux études, cependant, Aduhelm a démontré une réduction des plaques amyloïdes dans le cerveau [9]. La FDA a décidé que cette indication était "raisonnablement susceptible d'entraîner un bénéfice clinique" [10].
Un essai de confirmation de phase 4 (ENVISION) a débuté en juin 2022, à la demande de la FDA. Les résultats sont attendus pour 2026 [9].
Selon les informations de prescription d'Aduhelm, 35 % des patients ayant reçu le médicament dans le cadre d'essais cliniques ont souffert d'ARIA-E. 34 % des patients ayant participé aux essais ont souffert d'ARIA-H [15]. 34 % des patients ayant participé aux essais ont présenté des ARIA-H [15].
Comme le montrent les données actuelles, la principale différence entre Leqembi et Aduhelm à ce stade semble résider dans leur profil de sécurité, Leqembi présentant une incidence plus faible d'effets indésirables.
En même temps, d'après les données des essais cliniques actuels, Leqembi semble avoir un effet plus cohérent sur le déclin cognitif. Les résultats des essais en cours sur Leqembi et Aduhelm permettront d'en savoir plus sur les performances des deux médicaments.
NOTE : LES RÉSULTATS PRÉSENTÉS ICI LE SONT À TITRE D'INFORMATION : Les résultats présentés ici le sont à titre informatif et ne doivent pas servir de base à un choix de traitement. Votre médecin est le mieux placé pour déterminer le traitement le mieux adapté à votre cas.

Leqembi vs Aduhelm: Sécurité et effets secondaires
Selon les informations de prescription, voici les effets secondaires les plus fréquents de Leqembi (lecanemab) et Aduhelm:
Effets secondaires de Leqembi
- des réactions liées à la perfusion, notamment de la fièvre, des symptômes pseudo-grippaux, des nausées, des modifications du rythme cardiaque et un essoufflement ;
- maux de tête ;
- Anomalies d'imagerie liées à l'amyloïde (ARIA) [13]. Les ARIA peuvent se traduire par un gonflement ou une hémorragie temporaire dans le cerveau. Les symptômes de l'ARIA sont des maux de tête, une confusion, des crises d'épilepsie, des difficultés à marcher et des vertiges. Les porteurs homozygotes du gène de l'apolipoprotéine E peuvent présenter un risque plus élevé d'ARIA [14].
Effets secondaires d'Aduhelm
Les effets secondaires les plus fréquents de l'Aduhelm sont l'ARIA, les maux de tête et la chute. Un effet indésirable spécifié pour Aduhelm mais pas pour Leqembi est l'hypersensibilité. Les réactions d'hypersensibilité peuvent inclure l'œdème de Quincke (gonflement des couches profondes de la peau) et l'urticaire (éruption cutanée) [15].
Leqembi vs Aduhelm: Comparaison des prix
Lorsqu'il s'agit de médicaments qui ne sont pas encore largement disponibles, vous devez considérer tout prix comme une simple indication. Les coûts finaux tendent à varier en fonction de votre localisation, de vos fournisseurs ou de votre couverture d'assurance.
Pour vous donner une idée, un flacon à dose unique de Leqembi coûte environ 1 043 euros. Avec l'administration bihebdomadaire recommandée du médicament, les coûts annuels pour une personne s'élèvent à environ 27 118 euros [16].
Le prix indicatif de l'Aduhelm par flacon unidose est de 1 335 euros. En termes de coûts annuels pour une personne, cela représente 34 710 euros [17].
Où Leqembi et Aduhelm sont-ils approuvés ?
Leqembi (lecanemab) n'est actuellement autorisé qu'aux États-Unis et au Royaume-Uni, l'approbation de l'EMA étant attendue pour la fin de l'année 2024[3]. Leqembi a également déposé des demandes d'autorisation de mise sur le marché en Chine et au Japon [18, 19, 20].
Aduhelm (aducanumab) a reçu l'approbation accélérée de la FDA aux États-Unis en juin 2021. L'Agence européenne des médicaments (EMA) a rejeté la demande de mise sur le marché d'Aduhelm en décembre 2021. La demande a ensuite été retirée par Biogen en avril 2022 [21]. Le ministère japonais de la santé a également envoyé un signal négatif concernant l'approbation de l'Aduhelm dans le pays [22].
Leqembi ou Aduhelm n'est pas (encore) approuvé ou disponible dans votre pays ? Si vous et votre médecin pensez que ces traitements pourraient vous être bénéfiques, prenez contact avec notre équipe d'experts en accès médical. Nous pouvons vous fournir un devis personnalisé pour l'approvisionnement de ces médicaments.
Références :
- L'anticorps monoclonal anti-amyloïde Lecanemab : 16 mises en garde. Zenodo, 3 janvier 2023.
- Hamilton, Jon. La FDA accorde une autorisation accélérée au médicament Leqembi contre la maladie d'Alzheimer : Shots - Health News. NPR, 6 janvier 2023.
- Le comité consultatif de la FDA vote à l'unanimité pour confirmer le bénéfice clinique de LEQEMBI® (lecanemab-irmb) dans le traitement de la maladie d'Alzheimer. Biogen | Investor Relations, 9 juin 2023.
- Helmore, Edward. La FDA sous le feu des critiques pour l'approbation de l'Aduhelm, un médicament contre la maladie d'Alzheimer. The Guardian, 29 décembre 2022.
- POINTS FORTS DE L'INFORMATION SUR LA PRESCRIPTION. Leqembi, consulté le 3 août 2023.
- Taylor, Emma. Lecanemab, nouveau traitement de la maladie d'Alzheimer, fait les gros titres : quelle est la prochaine étape ? Alzheimer's Research UK, 13 décembre 2022.
- Eisai : Les patients atteints de la maladie d'Alzheimer voient les bénéfices de Leqembi même lorsque le traitement est interrompu. CNBC, 6 avril 2023.
- Leqembi | ALZFORUM. Alzforum, 30 mai 2023, consulté le 3 août 2023.
- Aduhelm | ALZFORUM. Alzforum, 6 février 2023, consulté le 3 août 2023.
- Cavazzoni, Patrizia. Décision de la FDA d'approuver un nouveau traitement pour la maladie d'Alzheimer. FDA, 7 juin 2021.
- Eisai présente les résultats complets de l'étude de phase III Clarity AD sur le lecanemab. Alzheimer Europe, 30 novembre 2022.
- Résultats préliminaires des études EMERGE et ENGAGE : Deux études de phase 3 pour évaluer l'Aducanumab chez les patients atteints de la maladie d'Alzheimer à un stade précoce. Biogen | Investor Relations, consulté le 3 août 2023.
- ID de référence : 5105416. Accessdata.fda.gov, consulté le 3 août 2023.
- GUIDE MÉDICAMENTEUX LEQEMBI® (leh-kem'-bee) (lecanemab-irmb), solution injectable, pour usage intraveineux. Leqembi, consulté le 3 août 2023.
- HIGHLIGHTS OF PRESCRIBING INFORMATION. Accessdata.fda.gov, consulté le 3 août 2023.
- Acheter Leqembi (lecanemab-irmb) en ligne - Prix et coûts. Everyone.org, consulté le 3 août 2023.
- Acheter Aduhelm (aducanumab-avwa) en ligne - Prix et coûts. Everyone.org, consulté le 3 août 2023.
- EISAI DÉPOSE UNE DEMANDE D'AUTORISATION DE MISE SUR LE MARCHÉ POUR LE LECANEMAB EN TANT QUE TRAITEMENT DE LA MALADIE D'ALZHEIMER PRÉCOCE EN EUROPE | Biogen. Biogen | Investor Relations, 10 janvier 2023.
- Eisai commence à soumettre les données du Lecanemab en Chine dans le cadre de la BLA | Biogen. Biogen | Investor Relations, 22 décembre 2022.
- Carvalho, Teresa, et Ray Burow. Lecanemab, pour les premiers stades de la maladie d'Alzheimer, va être examiné au Japon. Alzheimer's News Today, 14 mars 2022.
- Mise à jour sur la soumission réglementaire de l'Aducanumab dans l'Union européenne | Biogen. Biogen | Investor Relations, 22 avril 2022.
- Swift, Rocky, et al. Eisai-Biogen Alzheimer's drug difficult to assess-Japan ministry. Reuters, 22 décembre 2021.