Enhertu pour le cancer du poumon : Où est-il approuvé et comment l'obtenir ?
Dernière mise à jour : 15 juillet 2024
Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentEnhertu (fam-trastuzumab deruxtecan-nxki) est l'un des traitements anticancéreux à surveiller, depuis sa première approbation par la FDA en 2019 1.
Alors que la sécurité et l'efficacité de Enhertu dans le cancer de l'ovaire et le cancer colorectal sont encore à l'étude, le médicament est déjà approuvé pour plusieurs indications. Il s'agit notamment du cancer du sein HER2-positif, du cancer gastrique HER2-positif et du cancer du sein HER2-low. La FDA a également approuvé Enhertu pour le cancer du poumon non à petites cellules HER2-mutant. Le CHMP en Europe a récemment donné un avis positif pour faire de même dans l'UE 2.
Si vous êtes atteint d'un cancer du poumon au Royaume-Uni ou ailleurs en dehors des États-Unis et de l'Union européenne, vous vous demandez probablement quand vous pourrez accéder au site Enhertu .
Voici tout ce qu'il faut savoir sur Enhertu pour le cancer du poumon, et ce à quoi les patients du Royaume-Uni et du reste du monde peuvent s'attendre.
Quelle est l'indication de Enhertu pour le cancer du poumon ?
En tant que thérapie ciblée, Enhertu est uniquement destiné à traiter les cancers présentant une mutation HER2. En tant que tel, le traitement s'applique à environ 2 % de tous les patients atteints de CPNPC 3.
Enhertu est indiqué en monothérapie chez les patients adultes atteints de CPNPC avancé dont les tumeurs présentent une mutation activatrice de HER2 (ERBB2). Enhertu s'adresse aux patients qui ont déjà reçu un traitement systémique et dont le cancer s'est propagé à d'autres parties du corps ou ne peut pas être enlevé par voie chirurgicale 2.
Quel est le taux de réussite du site Enhertu pour le cancer du poumon ?
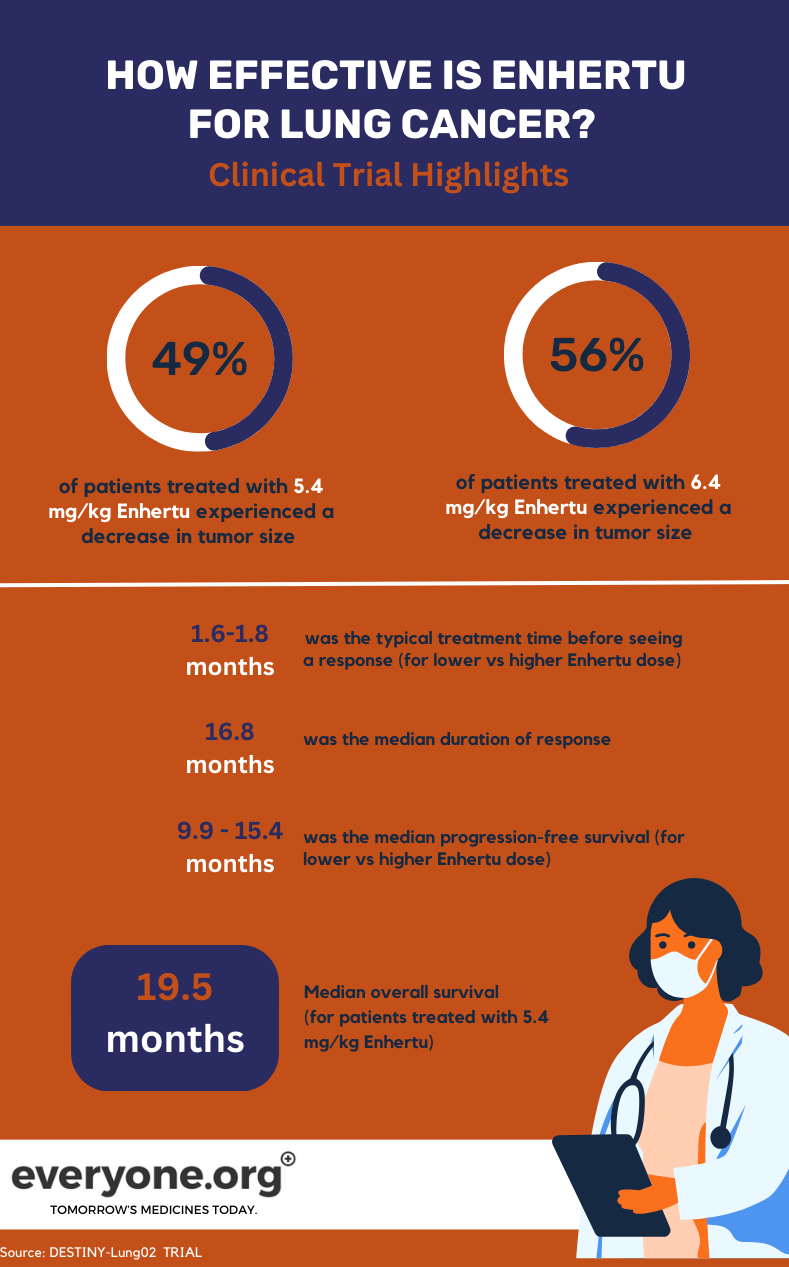
L'essai de phase II DESTINY-Lung02 en cours étudie l'innocuité et l'efficacité de Enhertu dans le traitement du cancer du poumon non à petites cellules (NSCLC) muté HER2. L'essai compare deux doses de Enhertu (5,4 mg/kg et 6,4 mg/kg).
Pour les patients atteints de cancer du poumon, les principaux résultats préliminaires de l'essai DESTINY-Lung02 sont les suivants :
- Les tumeurs ont régressé chez 49 % des patients traités avec la dose la plus faible ( Enhertu ) et chez 56 % de ceux traités avec la dose la plus élevée.
- Les tumeurs ont complètement disparu chez 1 % et 4 % des patients dans le groupe ayant reçu la dose la plus faible et la plus élevée, respectivement.
- La durée médiane de la réponse a été de 16,8 mois pour les patients du groupe ayant reçu la dose la plus faible ( Enhertu ). Pour les patients de l'autre groupe, la durée de réponse a été considérée comme non estimable.
- Le temps médian nécessaire pour observer une réponse initiale au traitement était de 1,8 mois et de 1,6 mois dans le groupe ayant reçu la dose la plus faible et dans le groupe ayant reçu la dose la plus élevée, respectivement.
- La survie médiane sans progression était de 9,9 mois à la dose de 5,4 mg/kg et de 15,4 mois à la dose de 6,4 mg/kg 4.
Quelle a été la médiane de survie pour les patients du site Enhertu ?
Pour les patients ayant reçu la dose la plus faible ( Enhertu ) dans l'essai clinique, la survie globale médiane (OS) était de 19,5 mois. La SG a été considérée comme non estimable pour le groupe 4 recevant la dose la plus élevée.
Quels sont les effets secondaires de Enhertu sur les poumons ?
Certains cas graves, menaçant le pronostic vital ou mortels de pneumopathie interstitielle ont été rapportés chez des patients du site Enhertu . Les patients présentant une insuffisance rénale modérée peuvent être exposés à un risque plus élevé 6.
Dans l'étude DESTINY-Lung02, une ILD a été signalée chez 12,9 % des patients du groupe recevant la dose la plus faible et chez 28 % des patients du groupe recevant la dose la plus élevée. La majorité de ces cas n'étaient pas graves. Une ILD de grade 3 ou plus a été rapportée chez 2 % des patients dans les deux groupes de patients.
EnhertuLe profil de sécurité du médicament pour le cancer du poumon est similaire à ses performances dans d'autres indications. Compte tenu de l'incidence plus faible des effets indésirables (38,6 % contre 58 %), la dose de 5,4 mg/kg est considérée comme le traitement optimal pour les patients atteints de cancer du poumon non à petites cellules 4.

Où le site Enhertu est-il approuvé pour le traitement du cancer du poumon ?
Actuellement, Enhertu est autorisé aux États-Unis, dans l'Union européenne, en Israël et au Japon pour le traitement des patients adultes atteints de CPNPC non résécable ou métastatique dont les tumeurs présentent des mutations activatrices de HER2 (ERBB2) 4.
Le site Enhertu est-il approuvé pour le traitement du cancer du poumon au Royaume-Uni ?
En juillet 2024, pas encore. Un projet final d'orientation publié par NICE en mars 2024 annonce que Enhertu ne sera pas disponible sur le NHS jusqu'à ce qu'un prix rentable soit disponible. En attendant, Enhertu n'est malheureusement pas disponible au Royaume-Uni pour le cancer du poumon 7.
Mon médecin peut-il prescrire Enhertu pour le cancer du poumon si le médicament n'est pas encore approuvé ?
La réponse courte est oui.
Enhertu a déjà été approuvé dans plusieurs pays pour le traitement du cancer du poumon non à petites cellules (NSCLC) muté HER2. Sur cette base, votre médecin est autorisé à prescrire le médicament pour cette indication, même s'il n'est pas encore approuvé dans votre pays.
Lorsqu'un médecin prescrit un médicament pour traiter une maladie pour laquelle il n'a pas (encore) été approuvé, on parle d'utilisation non conforme à l'étiquetage. Il peut être difficile d'exécuter une ordonnance pour une utilisation non indiquée sur l'étiquette dans certains pays, en fonction des réglementations locales et de la disponibilité. Cependant, il est toujours possible de l'exécuter en utilisant le règlement relatif à l'importation de patients désignés (Named Patient Import).
Votre médecin a pris la décision de vous prescrire Enhertu pour le traitement de votre cancer du poumon ? Notre équipe à www.everyone.org peut vous aider à obtenir ce médicament. Nous sommes spécialisés dans l'approvisionnement et la livraison de médicaments prescrits non approuvés ou non disponibles dans le pays du patient. Contactez-nous pour que nous puissions vous aider.
Références :
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Historique des approbations de la FDA. Drugs.com, 15 août 2022.
- Enhertu. Agence européenne des médicaments, consulté le 6 novembre 2023.
- HER2 et le cancer du poumon. American Lung Association, consulté le 6 novembre 2023.
- Enhertu AstraZeca adémontré des réponses tumorales fortes et durables dans le cancer du poumon avancé mutant HER2 précédemment traité dans l'essai de phase II DESTINY-Lung02. AstraZeneca, 11 septembre 2023.
- Informations sur le projet | Trastuzumab deruxtecan pour le traitement du cancer du poumon non à petites cellules non résécable ou métastatique HER2-muté après 1 ou plusieurs thérapies [ID3934] | Guidance. NICE, consulté le 6 novembre 2023.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo, consulté le 6 novembre 2023.
- UK NICE rejects Daiichi Sankyo's Enhertu for breast cancer, Pharmaceutical Technology, consulté le 15 juillet 2024.