Enhertu peut-il traiter le cancer colorectal ? Derniers résultats, délais d'approbation, et plus encore.
Dernière mise à jour : 15 juillet 2024
Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentDepuis sa première approbation par la FDA en 2019, Enhertu a suscité beaucoup d'attention dans le monde de l'oncologie. En 2023, Enhertu poursuit sa trajectoire impressionnante avec deux autres désignations de percée de la FDA. Il peut désormais se prévaloir d'un total de sept 1.
L'une des dernières réalisations d'Enhertu est son approbation en tant que traitement diagnostique du cancer. Cela signifie qu'il peut désormais être appliqué à tous les patients atteints de tumeurs exprimant HER2, y compris les tumeurs colorectales. Pour tous les patients atteints de cancer colorectal, il s'agit d'une étape importante. En même temps, cela pose de nombreuses questions.
Voici tout ce qu'il faut savoir sur l'Enhertu pour le cancer colorectal.
Enhertu a-t-il été approuvé par la FDA pour le cancer colorectal ?
Oui. En avril 2024, l'utilisation d'Enhertu a été approuvée pour tous les types de cancer où l'expression de HER2 est présente. Cela inclut également le cancer colorectal.
Pour quels types de cancer le Enhertu est-il approuvé ?
Enhertu est actuellement approuvé par l'EMA en Europe pour le traitement de :
- Cancer du sein métastatique HER2-positif, qui ne peut pas être enlevé chirurgicalement ;
- Cancer du sein métastatique à faible taux de HER2, qui ne peut être éliminé par la chirurgie ;
- Cancer gastrique avancé HER2-positif (cancer de l'estomac) ou cancer de la jonction gastro-œsophagienne 4.
Aux Etats-Unis, Enhertu est également approuvé pour le traitement de :
- Cancer du poumon non à petites cellules métastatique mutant HER2 5.
- toutes les tumeurs solides exprimant HER2.
Quelle est l'efficacité d'Enhertu contre le cancer colorectal ?
Enhertu étant une thérapie ciblée, elle ne s'applique qu'aux cancers exprimant HER-2. Environ 3 à 5 % de tous les cancers colorectaux entrent dans cette catégorie 6.
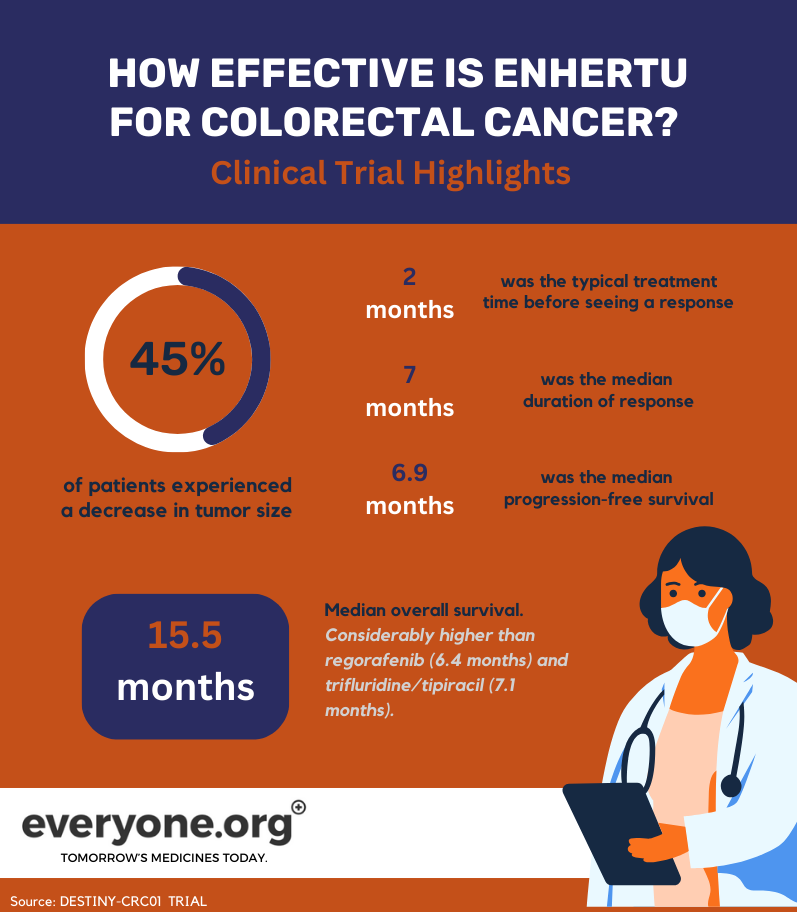
Résultats des essais cliniques
En juin 2023, les résultats finaux de l'essai DESTINY-CRC01 ont été publiés. Cet essai de phase 2 visait à évaluer l'efficacité et la sécurité d'Enhertu chez des patients atteints d'un cancer colorectal métastatique exprimant HER2. Les patients participant à l'essai avaient des tumeurs qui avaient progressé après au moins deux séries de traitements antérieurs 7.
Les principaux résultats de cet essai pour les patients atteints de cancer colorectal sont les suivants :
-
45,3 % des patients traités avec Enhertu ont connu une diminution partielle de leur tumeur ;
-
La réponse au traitement s'est généralement manifestée environ deux mois après le début du traitement ;
-
La durée médiane de la réponse a été de 7 mois ;
-
La survie médiane sans progression était de 6,9 mois ;
-
La survie globale médiane était de 15,5 mois. Ce résultat dépasse largement la norme de soins actuelle. Par exemple, le regorafenib et la trifluridine/tipiracil sont des thérapies de troisième ligne courantes. Ces traitements ont une survie globale de 6,4 mois et 7,1 mois, respectivement 7.
Un autre essai, appelé DESTINY-CTC02, étudie Enhertu pour les patients atteints de cancer colorectal. L'essai est toujours en cours, mais ses résultats préliminaires sont conformes aux résultats de l'essai DESTINY-CTC01 10.

Quelle est l'innocuité d'Enhertu pour le cancer colorectal ?
En termes de sécurité, voici les principaux résultats de l'étude DESTINY-CRC01 :
-
Chaque patient a souffert d'un effet secondaire du traitement. Les effets secondaires les plus fréquents étaient des problèmes d'estomac et de sang.
-
Des effets indésirables graves sont survenus chez 37,7 % des patients. Les effets secondaires graves les plus fréquents étaient un faible nombre de neutrophiles (22,1 %) et une anémie (14 %) 7.
-
Un effet secondaire appelé pneumopathie interstitielle a été associé à l'arrêt du traitement et a été observé chez 7 % des patients.
-
3 décès liés aux médicaments ont été signalés, tous associés à une pneumopathie interstitielle.
Qu'est-ce que cela signifie ?
Les résultats d'innocuité d'Enhertu ne peuvent pas être directement comparés entre différents groupes de patients. Cependant, pour vous aider à replacer les choses dans leur contexte, voici un résumé des résultats d'innocuité d'Enhertu pour plusieurs types de tumeurs. Y compris les tumeurs pour lesquelles Enhertu est approuvé :
-
Une pneumopathie interstitielle a été observée chez 12 % des patients participant à l'essai, avec une issue fatale dans 1,5 % des cas ;
-
Une diminution du nombre de neutrophiles a été observée chez 34,6 % des patients participant à l'essai ;
-
Une anémie a été observée chez 34 à 43 % des patients participant à l'essai (en fonction de la posologie du médicament) 8.
Par conséquent, le profil de sécurité d'Enhertu pour le cancer colorectal est similaire à son profil pour d'autres cancers approuvés.
Quand le Enhertu sera-t-il approuvé pour le cancer colorectal ?
Enhertu est déjà approuvé par la FDA pour le cancer colorectal HER2-positif - une indication qui entre dans le cadre de la dernière approbation d'Enhertu par la FDA.
Toutefois, cette dernière autorisation n'est effective qu'aux États-Unis. Qu'est-ce que cela signifie pour les patients atteints de cancer colorectal ailleurs ? Quel rôle pourrait jouer Enhertu dans le traitement de votre cancer colorectal ?
Mon médecin peut-il prescrire Enhertu pour le cancer colorectal ?
La réponse courte est oui.
Enhertu est déjà approuvé par la FDA pour le traitement du cancer colorectal HER2-positif. Même si vous êtes basé dans un autre pays, votre médecin est autorisé à prescrire le médicament pour cette indication. Il pourrait le faire sur la base des résultats finaux de l'essai DESTINY-CRC01 ou des résultats préliminaires de l'essai DESTINY-CRC02, et en fonction des spécificités de votre cas.
Si un médecin vous prescrit un médicament pour une maladie pour laquelle il n'a pas été approuvé localement, il s'agit d'une utilisation non conforme à l'étiquetage. Dans certains pays, il peut être difficile de faire exécuter une ordonnance pour une utilisation non indiquée sur l'étiquette en raison des réglementations locales et de la disponibilité des médicaments. Cependant, il est toujours possible de la faire exécuter en utilisant le règlement relatif à l'importation de patients désignés (Named Patient Import).
Votre médecin a pris la décision de vous prescrire Enhertu pour le traitement de votre cancer colorectal ? Notre équipe àeveryone.org peut vous aider à accéder à ce médicament. Nous sommes spécialisés dans l'approvisionnement et la livraison de médicaments prescrits non approuvés ou non disponibles dans le pays du patient. Contactez-nous pour que nous puissions vous aider.
Références :
- Barrie, Robert. Enhertu obtient deux désignations de thérapie révolutionnaire de la FDA. Pharmaceutical Technology, 31 août 2023.
- La FDA accorde la désignation de Breakthrough Therapy au Trastuzumab Deruxtecan pour les tumeurs solides HER2+, y compris le mCRC. OncLive, 31 août 2023.
- Une thérapie révolutionnaire. FDA, 4 janvier 2018.
- Enhertu | Agence européenne des médicaments. Agence européenne des médicaments, consulté le 30 octobre 2023.
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) FDA Approval History. Drugs.com, 15 août 2022.
- Biomarqueur HER2 dans le cancer du côlon. Know Your Biomarker, 24 mai 2023.
- Résultats finaux de l'étude DESTINY-CRC01 portant sur le trastuzumab et le deruxtecan chez des patients atteints d'un cancer colorectal métastatique exprimant HER2. Nature Communications, consulté le 30 octobre 2023.
- Enhertu, INN-trastuzumab deruxtecan. Agence européenne des médicaments, consulté le 30 octobre 2023.
- Trastuzumab Deruxtecan chez les participants atteints d'un cancer colorectal avancé ou métastatique surexprimant HER2 (DESTINY-CRC02). ClinicalTrials.gov, consulté le 30 octobre 2023.
- Trastuzumab deruxtecan (T-DXd) chez des patients (pts) atteints d'un cancer colorectal métastatique (mCRC) surexprimant/amplifié HER2 (HER2+) : Résultats primaires de l'étude multicentrique, randomisée, de phase 2 DESTINY-CRC02. Journal of Clinical Oncology, consulté le 30 octobre 2023.