Le dostarlimab est-il disponible en France (et que faire en attendant) ?
Dernière mise à jour : 05 février 2024

Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentLe dostarlimab (vendu commercialement sous le nom de Jemperli) est un nouveau traitement anti-PD-1. Il a reçu une autorisation de mise sur le marché conditionnelle de l'EMA en 2021 pour le traitement du cancer de l'endomètre avancé ou récurrent [1]. Il s’agit ainsi du premier traitement anti-PD-1 approuvé en Europe pour cette indication.
Pour les patients atteints de tumeurs déficientes en réparation des mésappariements (dMMR), il s’agit d’une étape importante. D’autant plus que l’innovation dans ce domaine est à la traîne, selon Jack Harris, vice-président UK Oncology chez GSK [2].
Cependant, ceux qui souhaitent commencer un traitement par dostarlimab en France auront peut-être besoin d'un peu plus de patience. Cela peut encore prendre un certain temps avant que le médicament soit largement disponible sur le marché.
Le site dostarlimab est-il approuvé au Royaume-Uni ?
Actuellement, le site dostarlimab est approuvé mais n'est pas encore largement disponible sur le marché britannique.
Après son AMM conditionnelle en 2021, le dostarlimab a également été évalué par la Haute Autorité de Santé (HAS). La HAS a rendu un avis défavorable à l'inclusion du dostarlimab dans le parcours de soins régulier du cancer de l'endomètre, ainsi qu'au remboursement du médicament [4].
Il est bon de savoir que l’avis de la HAS constitue une première évaluation. Elle s'est uniquement concentrée sur l'évaluation du médicament pour son indication dans le traitement du cancer de l'endomètre avancé ou récurrent dMMR/MSI-H. L’autre indication approuvée par la FDA du dostarlimab, le traitement de certaines tumeurs solides avancées ou récurrentes dMMR/MSI-H, n’a pas encore été évaluée par la HAS.
Il est possible que les résultats de l’évaluation changent lors des évaluations ultérieures ou lors de l’évaluation des autres indications du dostarlimab.
Quand le dostarlimab sera-t-il disponible en France ?
L'obtention de l'autorisation de mise sur le marché complète de l'EMA (attendue en 2024) sera la première étape vers la disponibilité du dostarlimab sur le marché français. Le médicament devrait être réévalué par la HAS. Si son inclusion dans le parcours de soins est approuvée, des décisions sur les tarifs locaux et sur la couverture d’assurance maladie devront également avoir lieu.
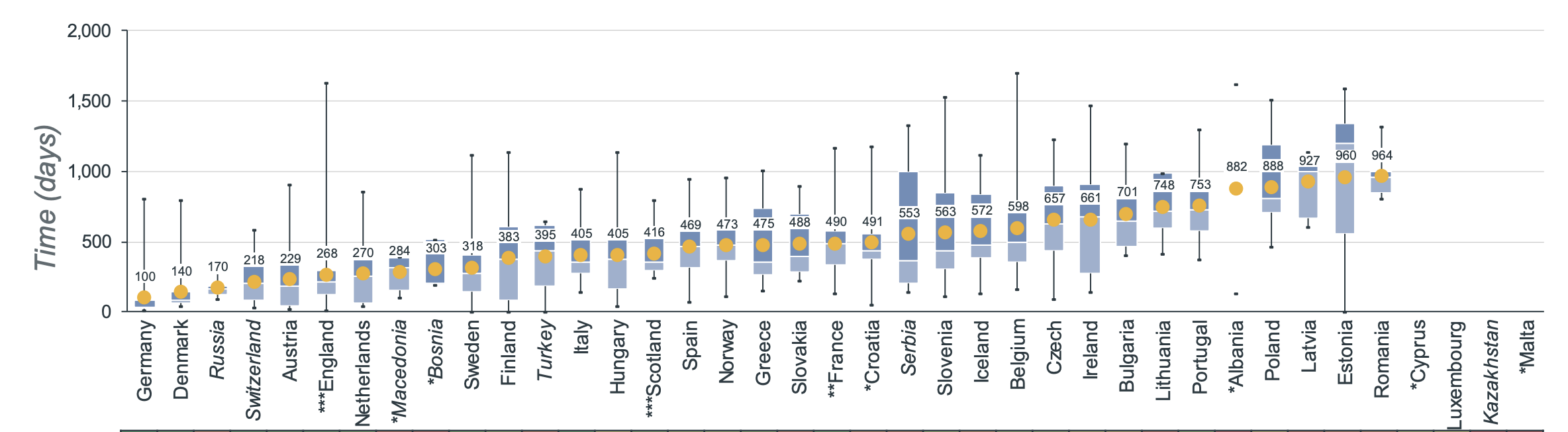
Le temps moyen nécessaire entre le moment où un médicament obtient l'approbation de l'EMA et le moment où il est disponible sur le marché varie considérablement selon les pays. La moyenne européenne des traitements en oncologie en 2022 était de 511 jours entre l’autorisation de mise sur le marché de l’EMA et la date de large disponibilité. En France, le délai moyen de disponibilité est de 490 jours [3].
Dans ce contexte, il faudra peut-être encore un certain temps avant que le dostarlimab soit largement disponible sur le marché français.

Comment obtenir dostarlimab au Royaume-Uni ?
Êtes-vous une patiente en France atteinte d'un cancer de l'endomètre ou d'une tumeur solide dMMR/MSI-H avancée ? Si votre médecin recommande un traitement par dostarlimab, vous avez le choix.
Lorsqu'un médicament n'est pas approuvé dans le pays d'un patient, ou qu'il est approuvé mais pas encore disponible, vous pouvez y accéder via la réglementation Named Patient Import.
Everyone.org est spécialisé dans l'aide aux personnes ayant accès aux derniers médicaments via cette réglementation. Si vous avez une prescription de Jemperli (dostarlimab) de votre médecin traitant, que vous êtes impatient de commencer votre plan de traitement et que vous souhaitez que nous vous aidions à accéder immédiatement au médicament, contactez-nous.
Références :
- Jemperli |Agence européenne des médicaments. Agence européenne des médicaments, 21 avril 2021.
- Cooper, Emma. Les patientes britanniques bénéficient d'un accès anticipé au traitement du cancer de l'endomètre de GSK. Pf Media, 10 juillet 2023.
- Enquête de l'EFPIA sur l'indicateur W.A.I.T. 2021. EFPIA, consulté le 25 septembre 2023.
- Early Access to Medicines Scientific Opinion - Public Assessment Report Product Dostarlimab EAMS indication Dostarlimab. GOV.UK, 29 juin 2023.
- Ewbank, Leo. Accès aux nouveaux médicaments dans le NHS anglais. The King's Fund, 28 octobre 2020.
- Parsons, Lucy. L'inhibiteur PD-1 de GSK Jemperli approuvé au Royaume-Uni. Pharma Times, 7 juin 2021.