Approbation de la Lurbinectedin par l'EMA : Va-t-elle arriver (et quand) ?
Dernière mise à jour : 23 avril 2024

Vous pouvez légalement accéder à de nouveaux médicaments, même s'ils ne sont pas approuvés dans votre pays.
Apprendre commentLa Lurbinectedin a été désignée comme médicament orphelin par la FDA et l'EMA. Elle a également été incluse dans le projet Orbis de la FDA pour l'approbation accélérée de médicaments oncologiques concomitants 6. Il s'agit là de signes d'espoir pour tous les patients atteints de cancer du poumon à petites cellules, ce qui laisse entrevoir la possibilité d'une procédure d'approbation plus rapide pour ce médicament.
Cependant, plus de 5 ans après sa désignation comme médicament orphelin et 3 ans après son approbation accélérée par la FDA, Zepzelca lurbinectedin attend toujours son approbation par l'EMA.
Combien de temps les patients atteints de cancer du poumon en Europe et au Royaume-Uni doivent-ils encore attendre pour avoir accès à ce traitement ? Découvrez les dernières nouvelles, y compris les options qui s'offrent à vous pour obtenir la lurbinectedin avant qu'elle ne soit largement disponible.
Quelle est l'utilité de lurbinectedin ?
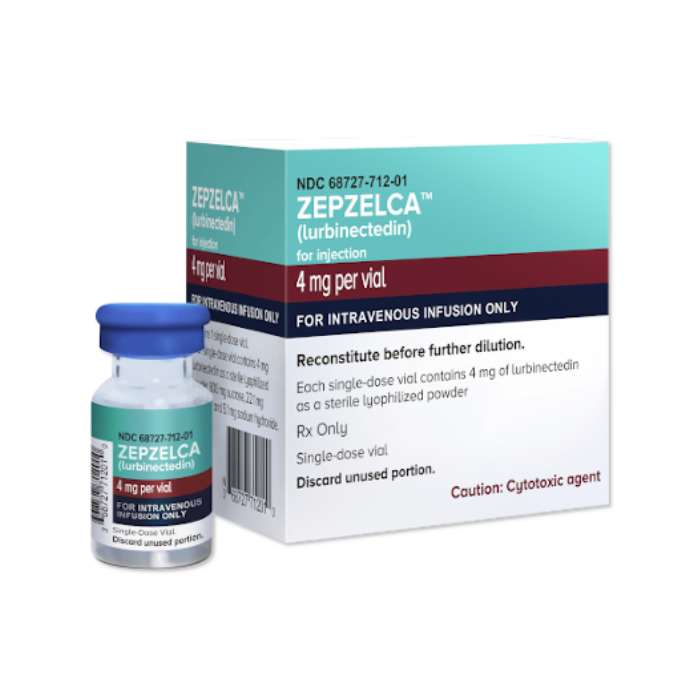
Zepzelca lurbinectedin) est un médicament délivré sur ordonnance pour le traitement du cancer du poumon à petites cellules (CPPC) métastatique chez l'adulte. Il est spécifiquement destiné aux patients dont la maladie a progressé après une chimiothérapie 1.
Quel est le taux de réussite de lurbinectedin?
La FDA a accordé une autorisation accélérée au Zepzelca sur la base de l'étude PM1183-B-005-14. Voici ce que les résultats rapportés nous apprennent sur le taux de réussite de la lurbinectedin dans le traitement du SCLC :
-
35 % des patients ont vu leur tumeur diminuer ou disparaître ;
-
La durée médiane de la réponse a été de 5,3 mois ;
-
Parmi les effets indésirables les plus fréquents, citons la leucopénie, la lymphopénie, la fatigue, l'anémie, la neutropénie, l'augmentation de la créatinine, de l'alanine aminotransférase ou du glucose 1.
Lurbinectedin essais de confirmation
Afin de conserver l'approbation de la FDA, le fabricant de la lurbinectedin a dû mener une étude de confirmation. Cette étude de phase 3, appelée ATLANTIS, n'a pas réussi à démontrer une amélioration statistiquement significative de la survie globale par rapport à la chimiothérapie seule.
Cependant, ce résultat peut être dû à la conception de l'étude. Par exemple, l'étude a testé une dose de lurbinectedin inférieure à celle approuvée et l'a combinée avec un agent chimiothérapeutique. C'est pourquoi la FDA a décidé de maintenir l'approbation du Zepzelca. Afin de confirmer son efficacité, le fabricant doit fournir les données d'un nouvel essai de confirmation avec une conception appropriée.
Actuellement, deux essais de confirmation pour la lurbinectedin sont en cours. L'essai LAGOON se terminera en juin 2025 et l'essai IMForte en mars 2026. Il est à espérer que les données de ces essais soutiendront l'approbation prolongée du médicament aux États-Unis et contribueront à accélérer son approbation dans d'autres régions, telles que l'Europe.
Approbation de la Lurbinectedin par l'EMA : Où en est-on ?
En 2019, l'EMA a accordé à la lurbinectedin désignation de médicament orphelin pour le traitement du SCLC 2. Cependant, aucune demande officielle d'autorisation de mise sur le marché n'a été soumise à l'EMA depuis lors.
En général, à partir du moment où une demande d'autorisation de mise sur le marché est déposée, il faut compter jusqu'à 210 jours pour qu'une décision d'approbation soit prise. Ce processus peut être un peu plus rapide pour les médicaments orphelins. Quoi qu'il en soit, même si PharmaMar soumet aujourd'hui sa demande d'approbation auprès de l'EMA, elle pourrait obtenir une autorisation au plus tôt fin 2024-début 2025.
La Suisse fait exception à cette règle, puisque le médicament y a reçu une autorisation temporaire en mars 2023 4.
Quand lurbinectedin sera-t-elle disponible en Europe ?
C'est difficile à dire. Si une demande d'approbation de l'EMA pour la lurbinectedin est soumise avant la fin de l'année, une décision pourrait théoriquement être prise à la mi-2025. Si celle-ci est positive, il faudra encore 67 jours pour que l'approbation de Zepzelca par l'EMA devienne officielle.
À partir de ce moment, chaque État membre de l'UE peut entamer ses propres procédures de négociation des prix locaux, de remboursement et de lancement sur le marché local. La durée de ces procédures dépend du pays.
L'Allemagne a tendance à être le pays le plus rapide à lancer des médicaments orphelins nouvellement approuvés, dans un délai moyen de 102 jours. À l'autre extrémité du spectre, on trouve l'Estonie, où il faut en moyenne 1 081 jours pour qu'un nouveau médicament orphelin soit disponible 3.
En d'autres termes, il semble que lurbinectedin sera disponible dans l'UE au plus tôt à la fin de 2025 ou au début de 2026.
Quand Zepzelca sera-t-il disponible au Royaume-Uni ?
La MHRA a accordé au Zepzelca la désignation de médicament innovant en 2022. La même année, PharmaMar a déposé une demande officielle d'autorisation de mise sur le marché conditionnelle au Royaume-Uni 5.
Toutefois, aucune décision n'a été prise depuis lors. En avril 2024, la MHRA n'a pas encore approuvé la lurbinectedin. Le NICE a également suspendu son évaluation du médicament en vue d'une éventuelle inclusion dans le NHS. Aucun calendrier n'a été fourni par l'une ou l'autre agence concernant les décisions.
Comment obtenir en toute sécurité de la lurbinectedin avant son approbation par la MHRA et l'EMA ?
Êtes-vous un patient atteint de SCLC ? Si votre médecin estime que vous pourriez bénéficier d'un traitement par Zepzelca, vous n'aurez peut-être pas besoin d'attendre son autorisation en Europe ou au Royaume-Uni. Au lieu de cela, votre médecin et vous pourriez envisager de participer à un essai clinique sur la lurbinectedin . Ou d'acheter le médicament sur la base d'un traitement individuel (Individual Named-Patient).
Participer à un essai clinique de lurbinectedin
L'un des moyens d'accéder à Zepzelca lurbinectedin) est de participer à un essai clinique. Cela est souvent plus facile à dire qu'à faire, car vous et votre médecin devez trouver un essai qui recrute actuellement des participants dans votre pays. Vous devrez également répondre aux critères d'éligibilité de l'essai. Pour tout cela, vous aurez besoin du soutien de votre médecin traitant.
Voici quelques bonnes adresses pour commencer à chercher des essais cliniques en cours sur lurbinectedin :
-
ClinicalTrials.gov: Il s'agit d'une base de données contenant tous les essais cliniques menés aux États-Unis. Certains de ces essais sont également ouverts aux participants internationaux. L'essai clinique LAGOON en est un exemple. Il est basé aux États-Unis, mais il est également ouvert aux patients d'Europe et d'Asie.
-
EUClinicaltrials.eu : Il s'agit d'une base de données contenant tous les essais cliniques réalisés dans l'Union européenne. Actuellement, elle ne contient que des informations limitées sur les essais lancés avant le 31 janvier 2022. Pour ces essais, vous pouvez consulter le registre des essais cliniques de l'UE.
-
myTomorrows: Cette organisation aide les patients à trouver des options de traitement dans le cadre d'essais cliniques.
Acheter lurbinectedin en tant que patient désigné
Dans la plupart des pays, les patients sont autorisés à acheter et à importer des médicaments susceptibles d'améliorer leur qualité de vie ou de traiter des affections potentiellement mortelles. Si vous souhaitez avoir accès à Zepzelca avant qu'il ne soit disponible dans votre pays, cette option pourrait être la plus rapide pour vous et votre médecin.
Le règlement qui rend cela possible est connu sous le nom de règlement sur les importations de patients nommés. Les exigences administratives spécifiques peuvent varier d'un pays à l'autre. Cependant, dans tous les cas, ces critères doivent être respectés :
-
Le médicament en question est autorisé dans un autre pays et n'est pas (encore) autorisé ou disponible dans le pays du patient ;
-
Il n'y a pas d'alternative sur le marché local ;
-
Le médicament est destiné à un usage personnel ;
-
Le patient dispose d'une lettre de prescription de son médecin traitant ;
-
Le médecin assume la responsabilité du traitement. Cela peut nécessiter des documents différents d'un pays à l'autre.
Souhaitez-vous utiliser le règlement relatif à l'importation de patients nommément désignés pour obtenir de la lurbinectedin avant son approbation par l'UE ? Vous devrez d'abord consulter votre médecin traitant et obtenir une ordonnance appropriée.
Vous avez déjà une ordonnance ? Notre équipe peut vous aider à obtenir Zepzelca. Nous sommes spécialisés dans l'approvisionnement et la livraison de médicaments qui ne sont pas encore disponibles dans votre pays. Contactez-nous pour plus d'informations.
Références :
- ID de référence : 4624945. Accessdata.fda.gov, consulté le 23 avril 2024.
- EU/3/19/2143 - désignation orpheline pour le traitement du cancer du poumon à petites cellules. Agence européenne des médicaments, 9 avril 2019.
- Enquête de l'EFPIA sur l'indicateur W.A.I.T. des patients 2021. Efpia, consulté le 23 avril 2024.
- PharmaMar annonce l'approbation de Zepzelca® (lurbinectedin) pour le traitement du cancer du poumon à petites cellules métastatique en Suisse. Pharmamar, consulté le 23 avril 2024.
- PharmaMar a déposé une demande d'approbation de la lurbinectedin pour le traitement du cancer du poumon à petites cellules métastatique au Royaume-Uni. Pharmamar, consulté le 23 avril 2024.
- Projet Orbis. FDA, consulté le 23 avril 2024.